最新消息
[新品發佈] qEV Magnetic Concentration Kit (qEV胞外體磁性濃縮試劑盒)
目前濃縮EVs的選擇有哪些?
對於大體積的樣本, TFF切向流過濾是一個理想的選擇。當處理較小體積(例如,診斷檢測應用的體積)時, 超濾(例如Amicon Ultra)和捕獲顆粒(例如, 非磁珠版的qEV濃縮試劑盒)是目前的兩個主要選擇, 然而這兩種方法都很耗時, 根據其使用說明書, 使用超濾管平均需要至少幾十分鐘才能完成。同樣我們自己的非磁珠版qEV濃縮試劑盒也需要1小時做孵育。
儘管這種時間花費在許多實驗室環境中可能是可以接受的, 但在大規模分離純化樣本時, 它可能使診斷檢測在現實世界中無法進行。
此外, 兩種方法都需要離心機, 這會限制了自動化的實現, 再次影響可擴展性。出於這些原因,我們開發了一種新的解決方案。
qEV胞外體磁性濃縮試劑盒採用由已經用化學親和餌進行功能化的水凝膠聚合物組成的磁性Nanotrap®顆粒, 這種產品的性質特別適合自動化。
使用qEV胞外體磁性濃縮試劑盒需要多長時間?
將規定體積的磁性Nanotrap®顆粒添加到EV分離純化物中後, 樣品在室溫下孵育10分鐘(使用例如滾筒式孵育器混合), 接下來使用強磁鐵對磁性Nanotrap®捕獲顆粒複合物進行2分鐘吸附, 在仍然施加強磁鐵的情況下將上清液移除, 接著取下磁鐵後, 將沉澱物重新懸浮在所需的緩衝液中(例如裂解緩衝液)。總的來說, 這個過程大約需要20分鐘使其比其他方法快約4倍。由於該試劑盒不需要離心步驟, 因此該方法有潛力實現全自動化。
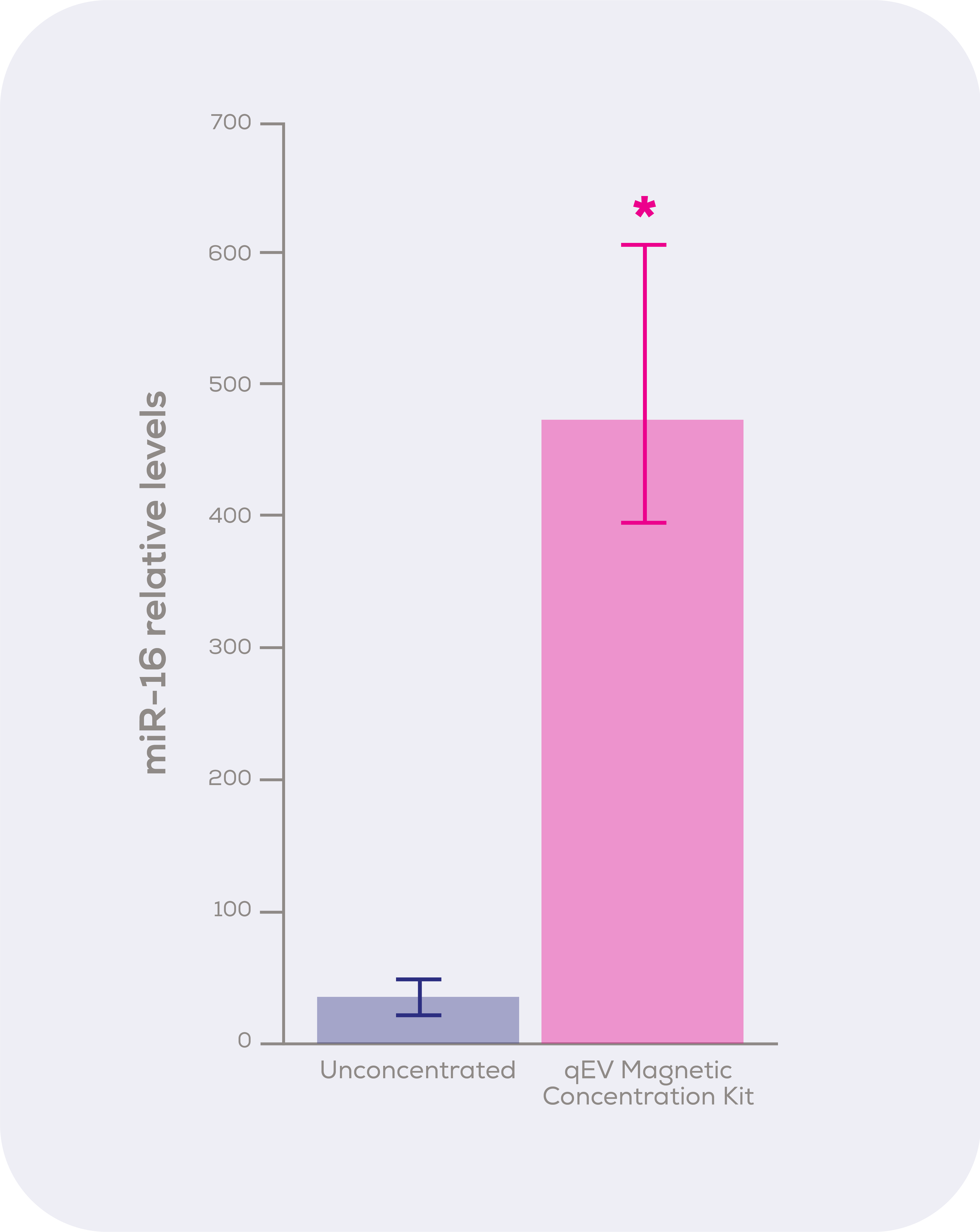
圖1. qEV胞外體磁性濃縮試劑盒的濃縮能力。從兩個qEVoriginal Gen 2中提取的純化收集體積(細胞培養基)被混合並分為兩份。一份保持未濃縮狀態, 另一份使用qEV胞外體磁性濃縮試劑盒進行濃縮, 接著使用qEV RNA Extraction Kit對未濃縮和濃縮樣本的等體積進行RNA提取, 然後進行miR-16的qPCR。*p<0.05
qEV胞外體磁性濃縮試劑盒的工作效果如何?
鑒於生物標誌物分析是qEV胞外體磁性濃縮試劑盒最可能的應用, 我們決定看看濃縮後是否更容易檢測到與EV相關的miRNA。如圖3所示, qEV胞外體磁性濃縮試劑盒完成了高程度的濃縮效果(p<0.05), 使得miR-16這個標誌物在濃縮樣本中比在未濃縮樣本中更容易檢測到, 這種提高的可檢測性可能是識別有價值的EV生物標誌物與否的關鍵。
實際的濃縮程度是可控的, 取決於重懸沉澱後的緩衝液體積。對於蛋白質或RNA分析, 可以通過直接重新懸浮在所選擇的裂解緩衝液中來獲得最濃縮的樣品, 從而防止不必要的稀釋。
qEV胞外體磁性濃縮試劑盒適用於什麼?
qEV胞外體磁性濃縮試劑盒使您能夠在進行需要高度富集的EV樣本或小體積下游分析之前捕獲和濃縮EVs。例如, 已濃縮的樣品適用於核酸分析(例如PCR或測序)和蛋白質分析(即Western blot或質譜)。請注意, Nanotrap顆粒和EV結合是不可逆的, 這意味著磁珠版qEV濃縮試劑盒不適用於功能分析或治療應用。
在qEV分離純化後捕獲和濃縮完整的EVs
qEV胞外體磁性濃縮試劑盒為在qEV分離純化後濃縮EVs提供了一個出色的選擇。使用磁鐵沉澱磁性Nanotrap®顆粒複合物使該方法成為診斷領域一個潔淨、高度可擴展和可自動化的選擇。與其他方法相比也要快得多, 使您能夠在其他方法處理一個樣本的時間內處理多個樣本。這使qEV胞外體磁性濃縮試劑盒成為診斷應用的理想夥伴, 在EV分離純化工作流程中擺脫了離心機的束縛。
相關連結可見: 產品介紹-qEV (Magnetic) Concentration Kit ( qEV 胞外體/磁性/濃縮試劑盒 )-qEV Magnetic Concentration Kit (qEV 胞外體磁性濃縮試劑盒)
Source: https://www.izon.com/news/qev-magnetic-concentration-kit
參考文獻
Newman, L. A., Useckaite, Z. & Rowland, A. Addressing MISEV guidance using targeted LC-MS/MS: A method for the detection and quantification of extracellular vesicle-enriched and contaminant protein markers from blood. Journal of Extracellular Biology 1, e56 (2022). https://doi.org/https://doi.org/10.1002/jex2.56
McNamee, N., Daly, R., Crown, J. & O'Driscoll, L. A method of separating extracellular vesicles from blood shows potential clinical translation, and reveals extracellular vesicle cargo gremlin-1 as a diagnostic biomarker. Translational Oncology 15 (2022). https://doi.org/10.1016/j.tranon.2021.101274
Brennan, K. et al. A comparison of methods for the isolation and separation of extracellular vesicles from protein and lipid particles in human serum. Scientific Reports 10 (2020). https://doi.org/10.1038/s41598-020-57497-7
Holcar, M. et al. Enrichment of plasma extracellular vesicles for reliable quantification of their size and concentration for biomarker discovery. Scientific Reports 10, 21346 (2020). https://doi.org/10.1038/s41598-020-78422-y
Veerman, R. E. et al. Molecular evaluation of five different isolation methods for extracellular vesicles reveals different clinical applicability and subcellular origin. Journal of Extracellular Vesicles 10 (2021). https://doi.org/10.1002/jev2.12128
Yang, Y. et al. Extracellular vesicles isolated by size-exclusion chromatography present suitability for RNomics analysis in plasma. Journal of Translational Medicine 19 (2021). https://doi.org/10.1186/s12967-021-02775-9
Dong, L. et al. Comprehensive evaluation of methods for small extracellular vesicles separation from human plasma, urine and cell culture medium. Journal of Extracellular Vesicles 10 (2020). https://doi.org/10.1002/jev2.12044
Fang, X. et al. A magnetic bead-mediated selective adsorption strategy for extracellular vesicle separation and purification. Acta Biomaterialia 124, 336-347 (2021). https://doi.org/10.1016/j.actbio.2021.02.004
Diaz Lozano, I. M. et al. Proteome profiling of whole plasma and plasma-derived extracellular vesicles facilitates the detection of tissue biomarkers in the non-obese diabetic mouse. Frontiers in Endocrinology 13, 971313 (2022). https://doi.org/10.3389/fendo.2022.97131