生醫工業中大規模客製化分離外泌體的要點與建議
CONSIDERATIONS FOR CUSTOMISING LARGE-SCALE EV SEPARATION
關於大規模客製化外泌體分離的要點與建議
如何才能有效率的實現”大規模”樣本體積的分離方式並成功的經由提取(純化)的步驟而取得”原始性”的外泌體呢? 許多現有的商品或傳統的超高速離心法(UC)早已在研究中被證實其並不適合放大產能, 為了能符合生醫領域的製造工廠的需求, 本篇專欄將詳細解說我們被國際所認可的建議方案, 同時符合客製化+多組份的雙重策略以提取出大量的細胞培養上清液的細胞外囊泡(Extracellular Vesicles, EVs)。
目的
在臨床需求上, 如何顯示出EVs的”原始性”一直是其蘊含的巨大潛力並不斷地被開發中, 特別是其可表示出各種生理與病理的條件狀態。
維持EVs的原始性就是代表了其原始組份相關的特性和能力, 特別適用於治療的應用範圍中; 例如其可有效的進入靶細胞、進行生理性貨物的傳遞、低免疫原性、低細胞毒性、高度的生物利用性、高度的生物相容性與高度的組織趨向性等方面。
用途與固有的限制
EVs可進行深度的”工程化”修飾以改進其穩定度、藥物附載能力和細胞靶向性。
然而相對於其他類似的脂質奈米結構粒子(例如合成的脂質體)已可被建立一套工程化生產的技術來比較, 使用在治療應用的EVs (更複雜的生物原樣)中存在著缺乏部分”臨床規格”的標準純化方式。
在各種領域內例如醫學治療的方式、藥物傳遞的系統、病毒、藥妝與保健品的應用中, 不論其製備EVs的目標為何, EVs的生產與純化的數量必需能同時滿足規定的品質規範與其應用的目標。
大規模EV分離的關鍵考量與前處理方式
原始樣品培養後, 在考量將EVs與其他物質分離時, 一定要注意要先用”Clarification”(澄清)的過程以去除大部分的負載汙染物。
"澄清"的過程是移除其所包含之殘存的細胞與細胞碎屑, 以確保接下來的EV分離的效果; 一般認可的澄清策略為連續的步進方式, 列舉如下:
1. 從低速至高速(比如200 xg, 2000xg, 20000xg)的離心法
2. 以薄膜為基礎的微量過濾方式(微米/亞微米尺度的孔洞, 比如0.1, 0.45, 5 µm)
3. 以分子量截留的超濾方式(比如10, 100, 300, 750 kDa), 這種方式還有機會可以額外增加EVs的豐度
4. 最好的方式是結合了以上兩種以上的方法來進行
在大規模EV操作時有許多不合宜的方法
在EV分離方式的選擇時會需要考慮兩項結果: “回收率”與”特異性”。
- 回收率代表的是從起始的EV樣品體積(包含其種類和相關的複合物)內可得到的最終EV產出量
- 特異性代表的是將EV與非EV的物種分離出的程度
傳統的方式通常會以Ultracentrifugation (UC)超高速離心法為首要考量, 但是其卻早被證實在高速離心下, EVs的物理完整性會被破壞, 更進一步的是UC法會被受限於其”處理的容量”(例如試管與轉子容量)與設備的要求, 這都會導致其整體生產力低下; 更重要的是此法會在人員或各實驗室之間有較大的變異性而不能被當成一個標準化的方式。
第二種是density gradient centrifugation (DGC)密度梯度離心法, 其是利用EV的粒徑/密度的差異以移除非EV的汙染物並被報導說成是”gold standard”; 但與UC法相比, DGC法在每次的操作時還更受限於體積處理的容量, 也非常需要有高度經驗人員的操作。
其他的方法大都是以沉澱原理的試劑盒, 但其並沒有使用任何標準的特異性將EVs與非EV的物質分離, 包含有多種缺點: 例如其牽涉到潛在的不想要的化學反應並可能會破壞EV的生物標誌物、導入的沉澱試劑需要再進行移除和可能會引起蛋白團聚等現象。
以上的方式在EV的製造過程中都不被歡迎, 總結就是超長的處理時間、非常高昂的成本和非必要的產品損失。
SEC尺寸排阻色譜法, 一種極具吸引力的EV分離方式
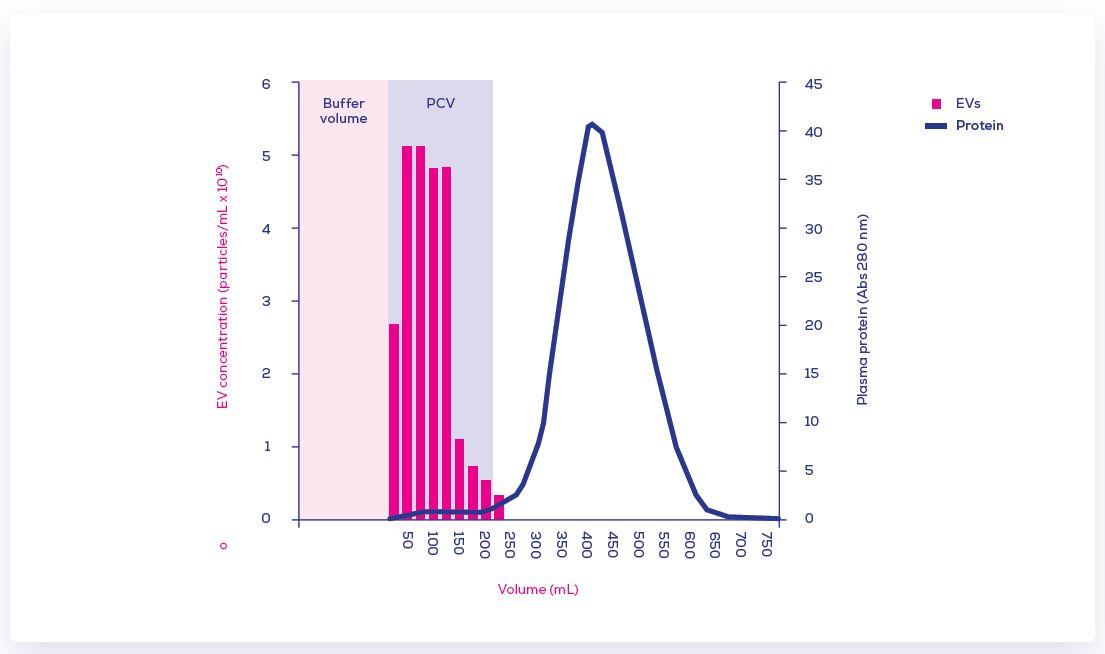
Size Exclusion Chromatography (SEC)尺寸排阻色譜法已經是非常普遍被認證的方式, 主要是其簡便、標準化、快速的流程、乾淨的純化過程、可保證EV原始的物性與化性, 特別的是可維持EV高度的回收率。SEC法是以粒子尺寸為基礎而填充了適合EV孔洞大小的樹脂在管柱中, 全利用流體的自然滴落, 大於孔洞的EVs粒子會先流洗出, 而小的粒子(主要是雜蛋白)會因其可進入孔洞後再流洗出而分離兩者, 這樣的SEC方式即可持續的提供可信而快捷的EVs分離方式(以血漿/血清樣品為例)。
此圖即為使用qEV100/70nm的100 mL 的血漿樣品的洗脫曲線; 藍色代表的是雜蛋白會在後面的餾份中出現, 而粉色代表的是EV會在前面的餾份中出現; 使用TRPS分析EVs的濃度(80 - 300 nm範圍內)和測量280 nm吸收度以決定其相關的蛋白水平。
生物技術的研發中對於樣品取決的考量
在EV樣品的技術開發中, 需要考量的樣品要點包含:
- 起始的樣品體積大小
- 樣品的進樣流速
- 洗脫的流速
- 汙染物的生物物理特性
- 目標的EVs粒子
- 預期的EVs產率
- 所需的EVs劑量(包含數量、循環的次數和給藥的路徑)
- EVs製備後的儲存能力
值得說明的是, 如預期在需要高產量500 mL或以上的上清液EV細胞系統中(例如MSCs間質幹細胞)才可在受體的生物中有足夠的EVs粒子達成可見的成果; 比如在小鼠中的劑量約需50-100 µg的EVs; 對於更大的動物模型中, 劑量的需求就會顯著的增加, 例如在非人類的靈長類與豬隻中就分別需要1 mg與2.7 x 1011/kg的單次劑量。
相反的, 低劑量也可用來達到成功的結果, 例如以本體的MSC-EVs做為第二期與第三期的臨床試驗治療中, 動脈注射100 µg的EVs/kg/單劑或大約106的EVs粒子/kg/單劑; 靜脈注射則約2-4 x 109的MSC-EVs粒子劑量。
EV相關應用於一般生物性製劑的要點
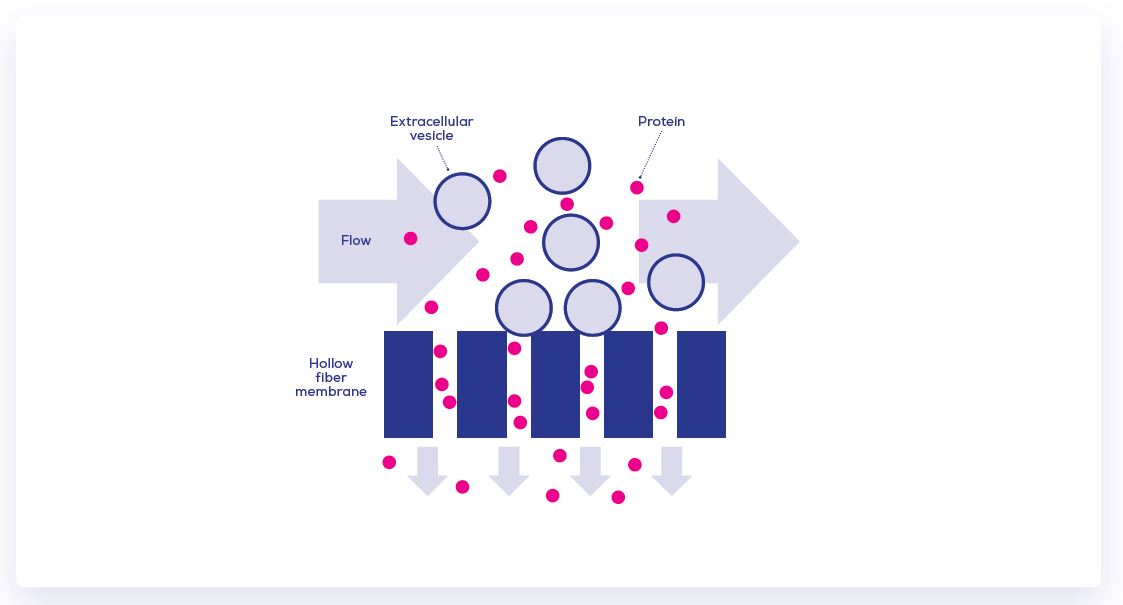
在生物製藥工業中, 生物製劑例如抗生素或抗體, 使用超濾過程進行濃縮是非常普遍的方法, 包含cross flow filtration, CFF(或被稱為TFF切向流過濾); 與傳統的終端過濾法相比, CFF可更有效的避免膜的結垢與堵塞, 然而這並不能用於分離EVs與雜蛋白粒子, 接續還是要進行特定的EV純化過程(SEC qEV column)。
此圖即為CFF的示意圖, 以壓力驅動的流體會平行的通過過濾器/薄膜, 可使滯留的流液能重複循環和不斷的過濾以從較大體積的樣品中移除小的雜蛋白物質。
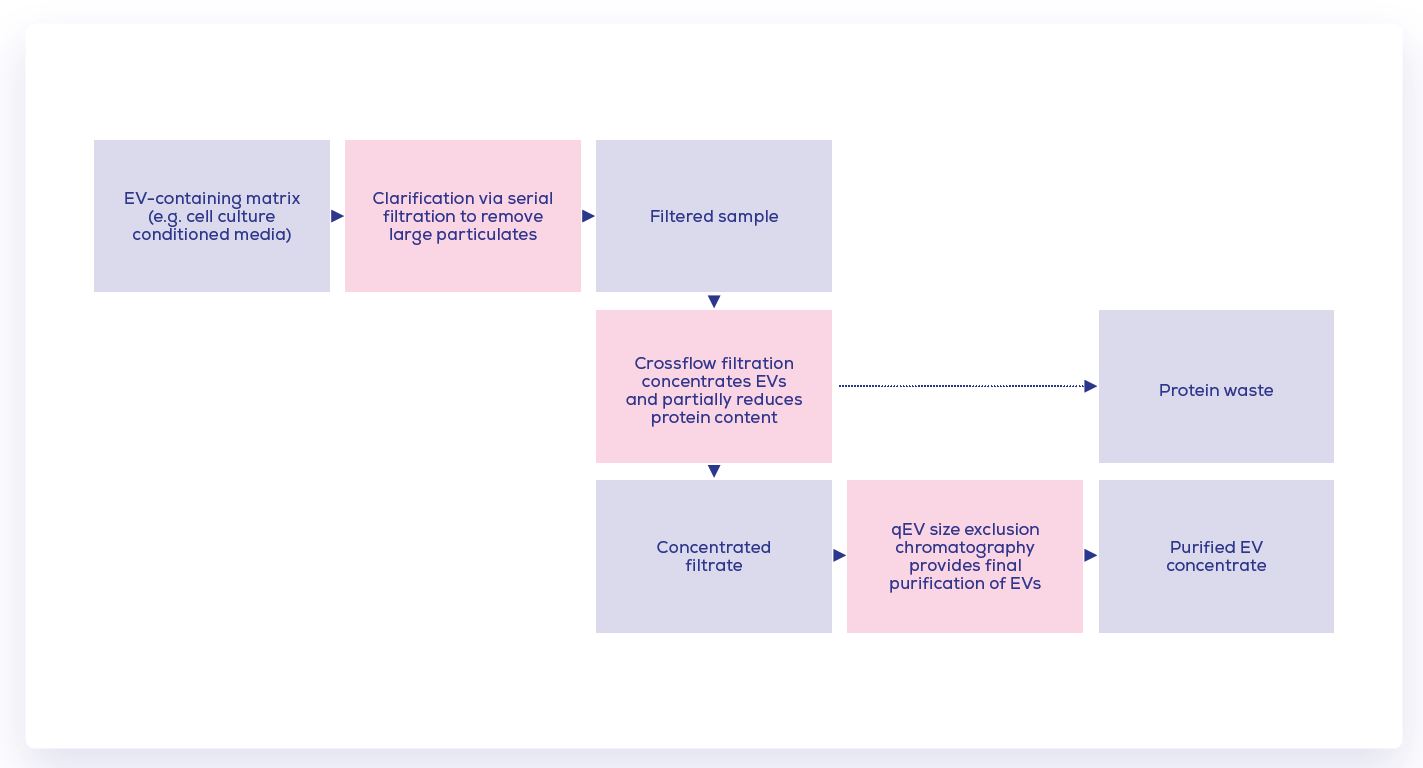
在已發表的臍帶間質幹細胞的結果顯示, SEC純化法相比UC法更可顯著的降低T細胞增殖和促炎細胞因子產生; 總結的說, 在大規模客製化的外泌體生產步驟為-
Step 1. 以“Clarification”澄清的過程先移除大的粒子
Step 2. 接著以濃縮的過程來移除更小的汙染物並減少樣品體積
Step 3. 最後以SEC的方式做純化以得到外泌體產品
建議的實驗製備流程
我們建議的流程為IZON Science的qEV column(SEC管柱) + AFC-V2(自動提取) + TRPS(定量分析), 其最終的EV粒子濃度可達1 x 1012-14/mL, 總蛋白干擾可降低約95%, 這代表在每µg的蛋白干擾中的EVs粒子可提升5-10倍; 照著以上的流程, 起始原樣體積每批可達5-250 L, 未來就能再繼續計畫更優化的研究內容。
此圖即為整體的流程要點, 其已在最近的生醫公司合作中進行了試點研究, 主要是從已濃縮的細胞上清液中分離出胞外體; 其起始的流程為從400 mL的上清液體積開始, 目前正計畫做更放大的量能開發。
相關產品
 外泌體尺寸排阻色譜管柱 qEV columns (SEC) |
 外泌體自動餾份收集機 AFC-V2 |
 單顆粒奈米粒徑/數量濃度/Zeta膜電位分析儀 Exoid Nanoparticle Analyzer (TRPS) |
以上內容非經許可請勿任意複製轉發分享
更多的相關訊息, 歡迎和我們聯絡或來信洽詢: info@normanda.com
