如何從血液樣本内提取高純度的外泌體
ISOLATING EVs FROM BLOOD PRODUCTS USING qEV Columns
|
Extracellular vesicles(EV, 胞外體/細胞外囊泡)是由多種活化和凋亡的細胞類型所製造的外膜衍生物的廣泛分類。"EV"的內容包含Exosome(外泌體), Microvesicles微泡(有時稱為"microparticles"微粒子), Oncosomes(腫瘤小泡)和其他的囊泡, 主要是由其細胞的起源、大小和表面生物標記物所分類, 都可用於在細胞間轉移訊號與轉移分子到特定細胞分佈的能力, 這使得EV成為一個具有吸引力的工具用於診斷和治療應用的潛力。 雖然由血液衍生的EVs具有高度複合度和異質性的分佈, 在包含許多從多種的細胞起源的EV類型中, 血液衍生的EVs是一個有著高度價值來源的生物標記物的研究目標, 裡面有多種條件/疾病可在循環的EVs上有明顯的成分影響。 本篇流程將帶您了解如何考量實驗流程與使用qEV column(SEC)從血液中提取EVs的要點。 |
|
考量與建議 |
|
|
EV 來源 在設計EV分析的研究中, EV的來源是一個重要的考量點, 然而有些EV的研究會使用全血來進行, 這會造成要從其他的高豐度粒子物質中區別出EV是非常困難的, 且這種來源物還會被排除在EV的儲存和提取之外, 所以其應用的數量就被限制了。 |
|
|
血液收集 血液收集的條件會很明顯的影響在血液樣品中的EV分佈的數量與表徵。收集的變數例如儲存溫度、運輸狀態、儲存時間、凝血劑和離心的方案都必需在所有的樣品中保持一致, 每個因素都會在處理樣品時影響EVs的數量。 |
| 步驟 | 內容 | ||
| 1. EV來源 | 全血/血漿/血清 | ||
| 2. 收集血液 | 選擇採血管/抗凝劑 | ||
| 3. 轉移混和物 | |||
| 4. 樣品處理 | 室溫下 200 x g 離心20分鐘, 去除細胞 (不含剎車) | ||
| 5. 樣品處理 | 5.1 室溫下 400 x g 離心15分鐘, 轉移上清液可得富含血小板的血漿(PRP), | 5.2 室溫下 1,550 x g 離心20分鐘, 轉移上清液可得少量血小板的血漿(PPP), | 5.3 室溫下 2,550 x g 離心15分鐘, 進行兩次, 轉移上清液可得無血小板的血漿(PFP), |
| 6. 轉移上清液 | |||
| 7. 選擇性儲存 | 分裝 或/和 在-80度下儲存 | ||
| 8. qEV提取 | 使用適合的qEV columns進行EV純化 | ||
| 9. 丟棄預設的緩衝液體積(Buffer Volume, BV) | |||
| 10. 純化的EV樣品 | 得到"純化收集體積"(PCV) | ||
| 11. 選擇性濃縮 | 11.1 如果需要進行功能試驗, 就使用離心過濾來濃縮PCV體積(MWCO = 100-300 kDa) | 11.2 如果需要表徵EV的"貨物", 就使用qEV Concentration Kit來濃縮PCV體積 | |
| 凝血劑 | 試管 | 行動模式 | EVs的影響 |
| 檸檬酸三鈉 | 藍蓋 | 藉由鈣結合防止血液結塊 | 最常用的凝血劑; 國際血栓與止血學會推薦採用 |
| EDTA | 紫蓋 | 藉由鈣結合防止血液結塊 | 可能會活化血小板; 適用於RNA分析 |
| 肝素鈉 | 綠蓋 | 抑制凝血酶和凝血活酶來防止結塊 | 通常不推薦於EV研究中; 可能會活化血小板; 可能會堵塞其他細胞攝取EV; 干擾PCR的反應 |
| 檸檬酸葡萄糖 (ACD) | 黃蓋 | 藉由鈣結合防止血液結塊 | 會影響紅細胞滲透壓的平衡, 導致EV內的成分/釋放的改變; 推薦用來分析微泡(微粒子); ACD和CTAD會比檸檬酸鹽更可有效避免血小板活化和釋放血小板的EVs |
|
樣品處理 |
|
EV提取前的儲存 |
|
qEV 提取 |
相關商品
 外泌體尺寸排阻色譜管柱 qEV columns (SEC) |
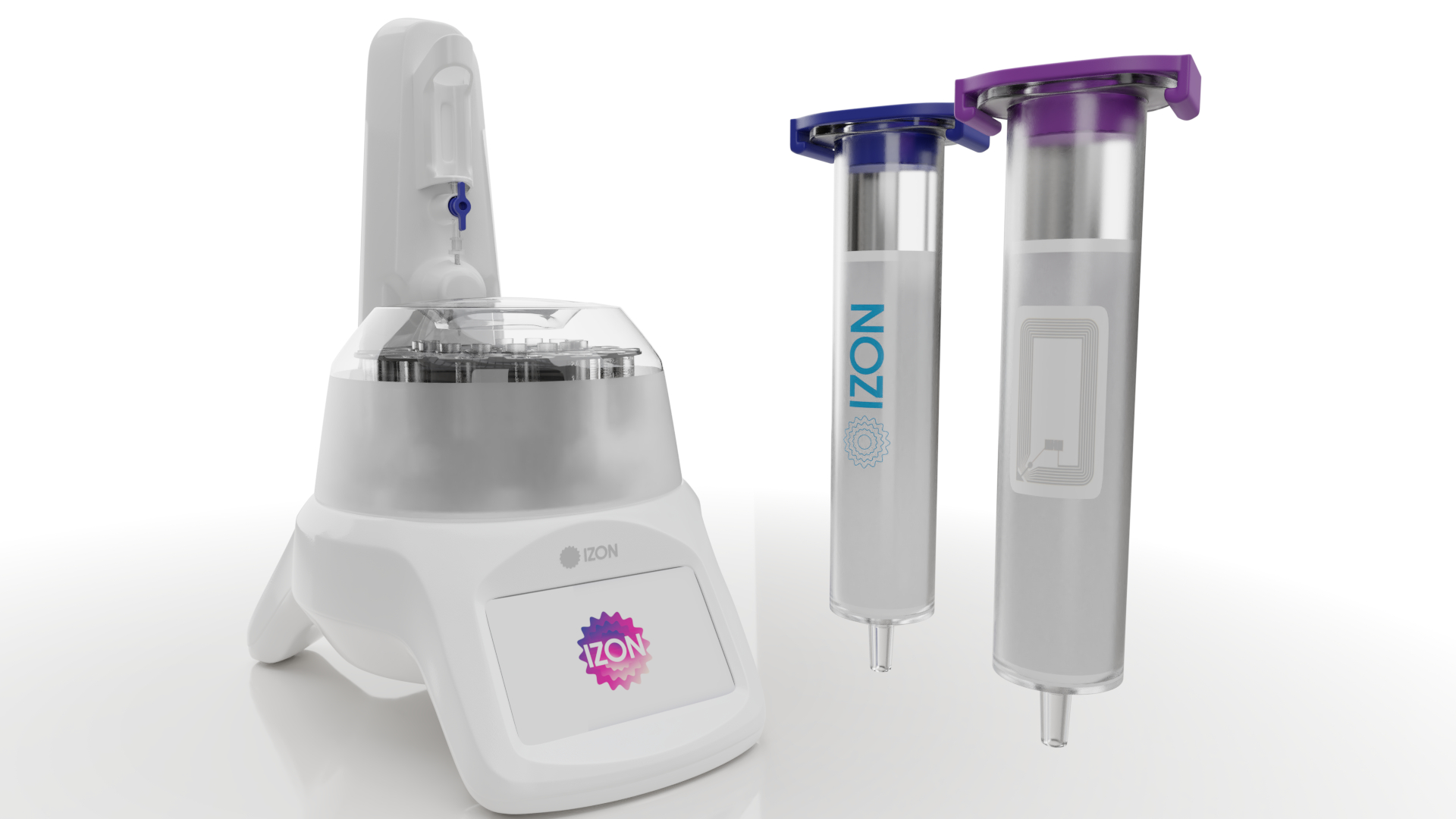 外泌體自動餾份收集機 AFC-V2 |
 單顆粒奈米粒徑/數量濃度/Zeta膜電位分析儀 Exoid Nanoparticle Analyzer (TRPS) |
|
以上內容非經許可請勿任意複製轉發分享
更多的相關訊息, 歡迎和我們聯絡或來信洽詢: info@normanda.com
