最新消息
2022-03-22
[新知分享] 以SEC 尺寸排阻色譜分離管柱從尿液樣品中分離純化胞外體
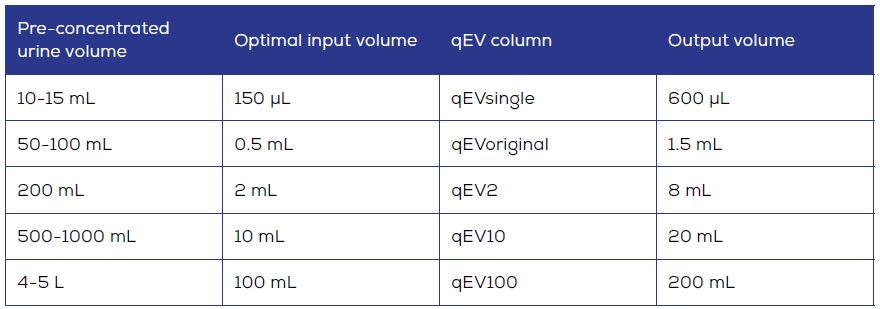
簡介: 尿液Urine是一種重要的生物液體並已被證實含有多種的胞外體(Extracellular vesicles, EVs), 包括外泌體(exosome)、微泡(MVs)和凋亡小體, 所以尿液-EVs是一種非侵入性很好的發掘生物標誌物之蛋白質組和轉錄組的來源[1], 使用尺寸排阻色譜法(SEC)是一種非常廣泛應用的分離純化技術, 用於分離純化來自各種生物流體中不同大小分子的複雜混合物 [2,3]。 qEV colume是一種可從尿液中分離EV的高效又標準化的平台, 於2021年後陸續所推出的”Gen 2”二代qEV擁有更優秀的效率, 這些可以用來研究於早期揭示泌尿系統疾病或腫瘤的發展, 以AFC-V2自動餾份收集系統進行qEV分離純化過程可消除人為誤差並做到高精度、精簡的工作流程。 更多實驗內容可參閱"外泌體實驗流程-如何從尿液的樣品內提取高純度的胞外體" 一般性建议: 所有qEV column都有兩個分離範圍選擇: qEV/35nm系列以及qEV/70nm系列。最佳回收率的顆粒在35至350nm之間推薦使用qEV/35nm系列; 最佳回收率的顆粒在70至1000nm之間建議使用qEV/70nm系列。 qEV使用前的樣品預濃縮: 1. 尿液需要適當的預濃縮以便能達到EVs粒子濃度檢測的下限, 濃縮設備的大小和型號取決於樣品體積: 比如離心濃縮器適用於較小的樣品(ex: Amicon Ultra和Centricon Plus-70離心過濾裝置), 而使用切向流裝置(ex: Pellicon®(默克Millipore)或Minimate™(Pall Laboratory)))則用於較大的樣品體積。 2. 據報導, 100 kDa過濾膜的外泌體之純度會略高10 kDa。 3. 由於已達到了更高的流速, 以壓力驅動的切向流濃縮會更適用於體積超過”400毫升”的樣品, 而外泌體的損耗僅會在前50-100毫升樣品中出現。 樣品處理: 1. Tamr-Horsfall Protein (THP)又稱尿調素, 是正常人體的尿液內含量最多的蛋白質。該單體蛋白約為85 kDa但在尿液中大量存在, 總計可達幾百萬道爾頓的聚集體。當尿液濃縮時, 特別是在較低的pH值下, THP會形成一種凝膠而在低速離心過程中會吸附尿的外泌體粒子造成干擾 [4]。 2. 通過將尿液樣本在二硫蘇糖醇(DTT) 200 mg/mL中37°C孵育10分鐘後於17000 x g離心10分鐘即可去除THP。 上樣qEV column: 如果用高於推薦上樣體積的樣品量可能會導致後續EVs餾份的純度下降, 這是由於蛋白峰和EVs洗脫峰之間在這種情況下有更大的重疊區, 使得在EV餾份中的雜蛋白含量增加。例如: Gen 2 qEVoriginal的最佳樣品量是0.5 mL, 可收集到1.6毫升的EV餾份。
使用qEV從尿液中分離EVs的流程圖

qEV型號和推薦的EV zone收集體積
方法 1. 準備新鮮的1X PBS溶液, 然後使用0.22 μm篩檢程式過濾 2. 用室溫的PBS溶液平衡qEV column a. 緩衝液脫氣處理, 平衡緩衝液和qEV到室溫, 將有助於避免在凝膠中形成氣泡, 使凝膠開裂 3. 收集尿樣, 在4°C下180×g離心10分鐘, 然後在4°C下1,550×g離心20分鐘。在離心步驟之間將上清轉移到另一個管中, 注意不要破壞沉澱 4. 將無細胞和碎片的尿液樣本濃縮到建議的qEV上樣量 (見上表) 5. 原廠推薦使用例如Amicon®超離心篩檢程式(0.5 -15)和Centricon Plus-70離心裝置(容積可達400毫升)。對於較大的體積可使用切向流過濾系統, 例如Pellicon®(默克Millipore)和Minimate™(Pall Laboratory) 6. 如果濃縮後樣品粘稠, 在上樣qEV前請使用推薦的DTT孵育法去除Tami-Horsfall蛋白 7. 將合適型號的qEV固定在AFC-V2上或qEV支架上, 並上樣相應體積的樣品 a. 確保樣品的體積適合所使用的qEV型號 8. 開始收集空隙體積和EV餾份 a. 不同樣品的洗脫曲線和純度可能略有不同, 因此推薦首次純化樣品時, 對EV粒子濃度和蛋白質污染物的含量進行測量 9. 在完成EV餾份的收集後, 按照qEV說明書進行清潔和洗脫, 然後繼續下一個樣品或者封存/保存qEV 10. 尿液-EVs已準備於下游分析應用, 可使用TRPS分析用於EV的標準化表徵和量化(粒徑、濃度和電荷) 參考文獻: 1. Oeyen, E.; Van Mol, K.; Baggerman, G.; et al. Ultrafiltration and Size Exclusion Chromatography Combined with Asymmetrical-Flow Field-Flow Fractionation for the Isolation and Characterisation of Extracellular Vesicles from Urine. J. Extracell. Vesicles 2018, 7 (1), 1490143. 2. Lozano-Ramos, I.; Bancu, I.; Oliveira-Tercero, A.; Armengol, M. P.; Menezes-Neto, A.; Portillo, H. A. D.; Lauzurica-Valdemoros, R.; Borràs, F. E. Size-Exclusion Chromatography-Based Enrichment of Extracellular Vesicles from Urine Samples. J. Extracell. Vesicles 2015, 4 (1), 27369. 3. Cho, S.; Rhee, W. J. Development and Comparative Analysis of Human Urine Exosome Isolation Strategies. Process Biochem. 2019, S1359511319306579. 4. Fernández-Llama, P.; Khositseth, S; Gonzales, P., A.; Star, R., A.; Pisitkum, T.; and Knepper, M., A. Tamm-Horsfall Protein and Urinary Exosome Isolation. Kidney Intl. 2010, 77(8), 736-742.

 外泌體尺寸排阻色譜分離管柱qEV columns (SEC) [GMP-Ready]
外泌體尺寸排阻色譜分離管柱qEV columns (SEC) [GMP-Ready] 外泌體尺寸排阻色譜後濃縮試劑盒qEV Concentration Kit
外泌體尺寸排阻色譜後濃縮試劑盒qEV Concentration Kit 外泌體RNA提取試劑組Norgen Exosomal RNA Isolation Kit
外泌體RNA提取試劑組Norgen Exosomal RNA Isolation Kit 一次性血細胞計數盤Disposable Hemocytometer
一次性血細胞計數盤Disposable Hemocytometer 奈米磁珠分選細胞組Magnetic microbeads Cell Seperation Products
奈米磁珠分選細胞組Magnetic microbeads Cell Seperation Products 工業級切向流過濾系統qEV TFF
工業級切向流過濾系統qEV TFF 次世代外泌體自動餾份收集機AFC-V2
次世代外泌體自動餾份收集機AFC-V2 大規模外泌體尺寸排阻分離自動色譜系統qEV Zenco
大規模外泌體尺寸排阻分離自動色譜系統qEV Zenco 標準型大規模外泌體尺寸排阻分離自動色譜系統qEV Zenco Standard
標準型大規模外泌體尺寸排阻分離自動色譜系統qEV Zenco Standard cGMP大規模外泌體尺寸排阻分離自動色譜系統qEV Zenco Pro
cGMP大規模外泌體尺寸排阻分離自動色譜系統qEV Zenco Pro 高通量外泌體自動機械人純化系統qEV Dxter
高通量外泌體自動機械人純化系統qEV Dxter 高速(冷凍)微量離心機High-Speed (Refrigerated) MicroCentrifuge
高速(冷凍)微量離心機High-Speed (Refrigerated) MicroCentrifuge 組織均質與單細胞懸浮液製備儀DSC Single Cell Suspension Dissociator
組織均質與單細胞懸浮液製備儀DSC Single Cell Suspension Dissociator 精密微量電子天平Analytical Balance
精密微量電子天平Analytical Balance 智能攪拌機S-100 Intelligent Stirrer
智能攪拌機S-100 Intelligent Stirrer 單顆粒奈米粒徑/數量濃度/Zeta膜電位分析儀Exoid Nanoparticle Analyzer (TRPS)
單顆粒奈米粒徑/數量濃度/Zeta膜電位分析儀Exoid Nanoparticle Analyzer (TRPS) 超微量全波長分光光度計Nabi UV/Vis Nano Spectrophotometer
超微量全波長分光光度計Nabi UV/Vis Nano Spectrophotometer 微孔盤全波長多功能分光光度計Mobi UV/Vis Microplate Spectrophotometer
微孔盤全波長多功能分光光度計Mobi UV/Vis Microplate Spectrophotometer 超靈敏單管冷光計Lumi Single Tube Luminometer
超靈敏單管冷光計Lumi Single Tube Luminometer 自動/高通量細胞計數儀EVE PLUS / EVE HT Automatic Cell Counter
自動/高通量細胞計數儀EVE PLUS / EVE HT Automatic Cell Counter 自動螢光細胞計數儀ADAM-MC / ADAM-MC2 / ADAM-CellT Automated Fluorescence Cell Counter
自動螢光細胞計數儀ADAM-MC / ADAM-MC2 / ADAM-CellT Automated Fluorescence Cell Counter 全類型分光光度計Spectrophotometer
全類型分光光度計Spectrophotometer 接觸式化學冷光成像儀e-BLOT WB/SDS-Pages Touch Imager
接觸式化學冷光成像儀e-BLOT WB/SDS-Pages Touch Imager 超恆定二氧化碳細胞培養箱D181
超恆定二氧化碳細胞培養箱D181