什麼是LNP脂質奈米顆粒? 要如何製備和表徵呢?
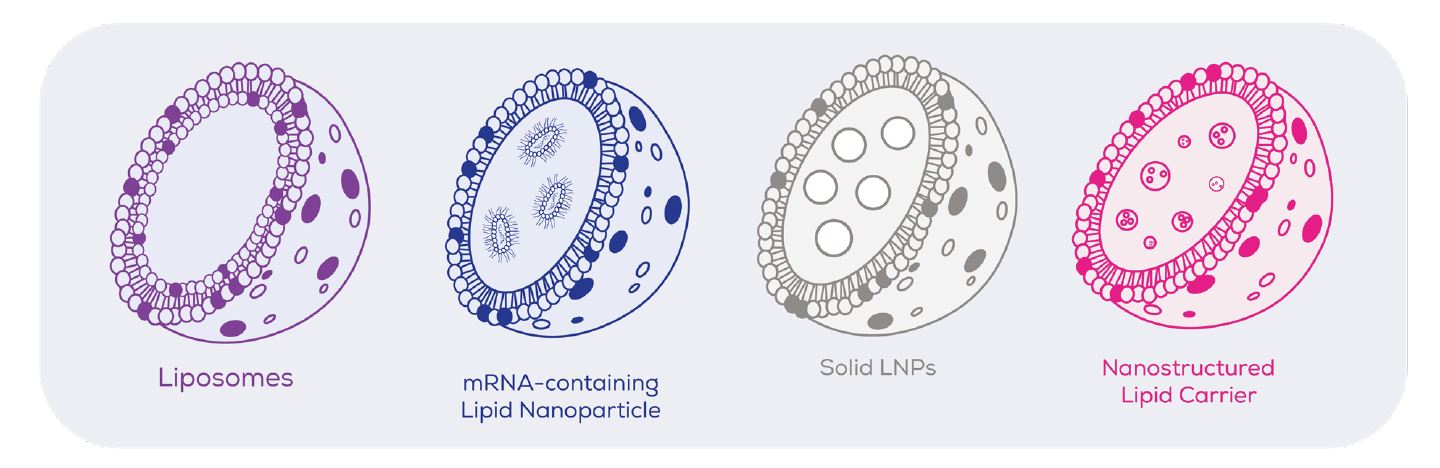
什麼是脂質奈米顆粒 (Lipid Nanoparticles, LNP)?
LNP脂質奈米顆粒作為一種先進的藥物遞送系統,近年來因其在 mRNA 疫苗 (如 Pfizer-BioNTech 和 Moderna 的 COVID-19 疫苗) 中的成功應用而備受矚目。
LNP 能夠有效保護如 mRNA 這類不穩定的大分子藥物,並將其精準遞送至目標細胞內, 其製備過程的優劣直接決定了 LNP 的粒徑、均勻性、包封率及最終的治療效果。
這裡我們將簡要的闡述 LNP 的主要製備與表徵方法:
LNP 形成的基本原理
LNP 的製備核心是於控制下的奈米沉澱(Controlled Nanoprecipitation)與自組裝(Self-Assembly)的過程, 其基本原理是將預先溶解於有機溶劑(最常用的是乙醇)中的脂質混合物與溶解有藥物分子(如 mRNA)的水相緩衝液快速混合, 當兩種溶液混合時, 有機溶劑會被水相稀釋, 其極性會發生劇烈變化導致脂質的溶解度迅速下降, 這種溶劑環境的改變會驅使疏水性的脂質分子發生自組裝過程而形成奈米級的顆粒結構, 並在此過程中將水相中的藥物分子包裹其中。
整個自組裝過程大致可分為過飽和 (Supersaturation)、成核 (Nucleation)、生長 (Growth)與穩定化 (Stabilization)這四個階段, 其中的參數如混合速度、流速比、溫度和脂質濃度等都會對這四個階段有著決定性的影響,從而決定了 LNP 的最終物理化學性質。
LNP的主要製備方法
LNP 的製備方法大致可分為由上而下 (Top-Down)和由下而上 (Bottom-Up)這兩類:
|
製備方法 |
分類 |
原理 |
|
高壓均質法 (HPH) |
由上而下 (Top-Down) |
將粗乳液在高壓下推過狹窄的通道,利用高剪切力、湍流和空穴效應將其破碎成奈米乳液。 |
|
超音波法 (Ultrasonication) |
利用超音波的空穴效應產生局部高壓和剪切力,將脂質分散體破碎成奈米顆粒。 |
|
|
薄膜水化法 (Thin Film Hydration) |
由下而上 (Bottom-Up) |
將脂質溶於有機溶劑後蒸發,形成薄膜,再加入水相緩衝液進行水化,形成多層脂質體,最後通過超音波或擠壓減小尺寸。 |
|
T型管/撞擊流混合法 |
將脂質-乙醇溶液和水相溶液分別從 T 型管或撞擊流混合器的兩端高速注入,在極短時間內實現劇烈混合。 |
|
|
微流體技術 (Microfluidics) |
在微米級通道中,利用層流特性精確控制脂質-乙醇溶液和水相溶液的混合過程,實現高度可控和可重現的 LNP 自組裝。 |
以微流體技術為例的LNP 製備標準流程如下:
步驟一: 溶液準備
(1). 脂質相製備
(2). 水相製備
步驟二: 微流體混合與自組裝
(1). 將脂質相和水相溶液分別泵入微流體晶片
(2). 在晶片內部將兩種溶液在層流狀態下進行快速、均勻且高度受控的混合
(3). 混合後會導致乙醇濃度迅速降低, 脂質溶解度下降而觸發自組裝過程,在毫秒級時間內形成包裹著 mRNA 的 LNP 核心結構
步驟三: 下游處理 (濃縮與純化)
(1). 溶劑去除、緩衝液置換與體積濃縮: 此時可使用qEV TFF(工業級切向流過濾系統)有效地去除乙醇,並將緩衝液置換為生理 pH 值的中性緩衝液 (如 PBS, pH 7.4),使 LNP 表面電荷趨於中性, 同時將 LNP 懸浮液濃縮至目標濃度
(2). 去除周遭環境的游離核酸或雜蛋白: 此時可使用qEV column(SEC, 尺寸排阻色譜分離管柱), 將背景的各種背景雜質移除, 留下乾淨的LNP顆粒
步驟四: 品質控制 (分析與表徵)
-
粒徑與多重分散指數(Span): 此時可使用Exoid奈米粒徑/濃度/Zeta電位分析儀(TRPS, 可調式電阻脈衝感應)進行分析, 以超高解析度的非光學原理得到單顆粒的數據資料, LNP的粒徑通常約落於80-120 nm
-
Zeta 電位: 一樣是使用Exoid奈米粒徑/濃度/Zeta電位分析儀(TRPS, 可調式電阻脈衝感應)進行分析, LNP顆粒在生理 pH 值時的Zeta電位應接近於中性
-
包封率(Encapsulation Efficiency): 使用 RiboGreen 等螢光染料法測定,衡量有多少比例的 mRNA 被成功包裹進 LNP 內部,通常要求 > 90%
-
藥物載量(Drug Loading): 測定每單位 LNP 中藥物的含量
-
穩定性: 評估 LNP 在不同儲存條件下的物理和化學穩定性
總之, LNP 的製備是一個涉及多種技術和精密控制的複雜過程。從傳統的薄膜水化法到現代的微流體技術,製備方法的不斷演進顯著提升了 LNP 的品質、重現性和生產效率。特別是微流體技術,憑藉其對混合過程的精準控制,不僅成為了早期研發階段高通量配方篩選的利器,也為實現從實驗室到大規模 GMP 生產的無縫放大提供了可靠的路徑。對 LNP 製備流程的深入理解和優化,是推動基於核酸藥物的下一代療法走向臨床和市場的關鍵所在。

 外泌體尺寸排阻色譜分離管柱qEV columns (SEC) [GMP-Ready]
外泌體尺寸排阻色譜分離管柱qEV columns (SEC) [GMP-Ready] 外泌體尺寸排阻色譜後濃縮試劑盒qEV Concentration Kit
外泌體尺寸排阻色譜後濃縮試劑盒qEV Concentration Kit 外泌體RNA提取試劑組Norgen Exosomal RNA Isolation Kit
外泌體RNA提取試劑組Norgen Exosomal RNA Isolation Kit 一次性血細胞計數盤Disposable Hemocytometer
一次性血細胞計數盤Disposable Hemocytometer 奈米磁珠分選細胞組Magnetic microbeads Cell Seperation Products
奈米磁珠分選細胞組Magnetic microbeads Cell Seperation Products 工業級切向流過濾系統qEV TFF
工業級切向流過濾系統qEV TFF 次世代外泌體自動餾份收集機AFC-V2
次世代外泌體自動餾份收集機AFC-V2 大規模外泌體尺寸排阻分離自動色譜系統qEV Zenco
大規模外泌體尺寸排阻分離自動色譜系統qEV Zenco 標準型大規模外泌體尺寸排阻分離自動色譜系統qEV Zenco Standard
標準型大規模外泌體尺寸排阻分離自動色譜系統qEV Zenco Standard cGMP大規模外泌體尺寸排阻分離自動色譜系統qEV Zenco Pro
cGMP大規模外泌體尺寸排阻分離自動色譜系統qEV Zenco Pro 高通量外泌體自動機械人純化系統qEV Dxter
高通量外泌體自動機械人純化系統qEV Dxter 高速(冷凍)微量離心機High-Speed (Refrigerated) MicroCentrifuge
高速(冷凍)微量離心機High-Speed (Refrigerated) MicroCentrifuge 組織均質與單細胞懸浮液製備儀DSC Single Cell Suspension Dissociator
組織均質與單細胞懸浮液製備儀DSC Single Cell Suspension Dissociator 精密微量電子天平Analytical Balance
精密微量電子天平Analytical Balance 智能攪拌機S-100 Intelligent Stirrer
智能攪拌機S-100 Intelligent Stirrer 單顆粒奈米粒徑/數量濃度/Zeta膜電位分析儀Exoid Nanoparticle Analyzer (TRPS)
單顆粒奈米粒徑/數量濃度/Zeta膜電位分析儀Exoid Nanoparticle Analyzer (TRPS) 超微量全波長分光光度計Nabi UV/Vis Nano Spectrophotometer
超微量全波長分光光度計Nabi UV/Vis Nano Spectrophotometer 微孔盤全波長多功能分光光度計Mobi UV/Vis Microplate Spectrophotometer
微孔盤全波長多功能分光光度計Mobi UV/Vis Microplate Spectrophotometer 超靈敏單管冷光計Lumi Single Tube Luminometer
超靈敏單管冷光計Lumi Single Tube Luminometer 自動/高通量細胞計數儀EVE PLUS / EVE HT Automatic Cell Counter
自動/高通量細胞計數儀EVE PLUS / EVE HT Automatic Cell Counter 自動螢光細胞計數儀ADAM-MC / ADAM-MC2 / ADAM-CellT Automated Fluorescence Cell Counter
自動螢光細胞計數儀ADAM-MC / ADAM-MC2 / ADAM-CellT Automated Fluorescence Cell Counter 全類型分光光度計Spectrophotometer
全類型分光光度計Spectrophotometer 接觸式化學冷光成像儀e-BLOT WB/SDS-Pages Touch Imager
接觸式化學冷光成像儀e-BLOT WB/SDS-Pages Touch Imager