外泌體尺寸排阻色譜分離管柱qEV columns (SEC)
快速簡單、直接自然滴落 | 精準有效、超高純度分離外泌體粒子與背景雜蛋白 | 20nm/35nm/70nm三種孔徑完美覆蓋細胞外囊泡所有範圍 | 標準化的隔離方式可規模化生產外泌體製劑
-
符合 ISO13485:2016 醫療器材品質管理系統規範
-
只需自然滴落, 10-15分鐘完成 EV Seperation
-
最純淨無損的方式
-
最新發佈 qEV/20 nm, 與 qEV/35nm & qEV/70nm 完整覆蓋細胞外囊泡所有範圍
-
洗脫後可重複使用
-
搭配 AFC-V2 外泌體餾份自動收集機可進行標準化流程
-
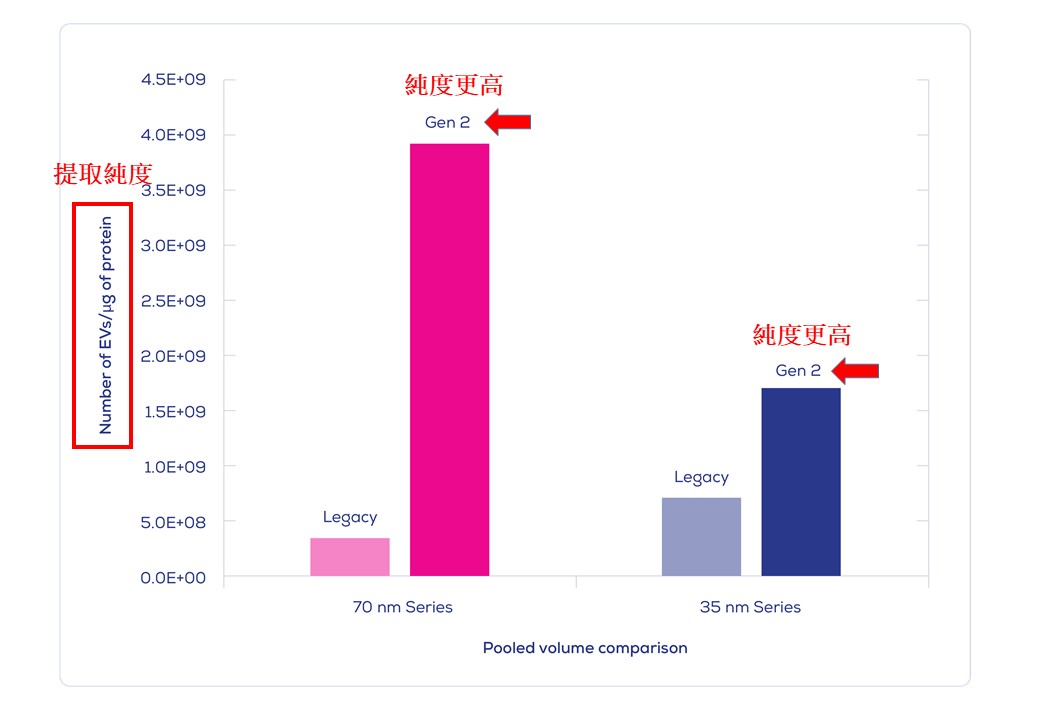
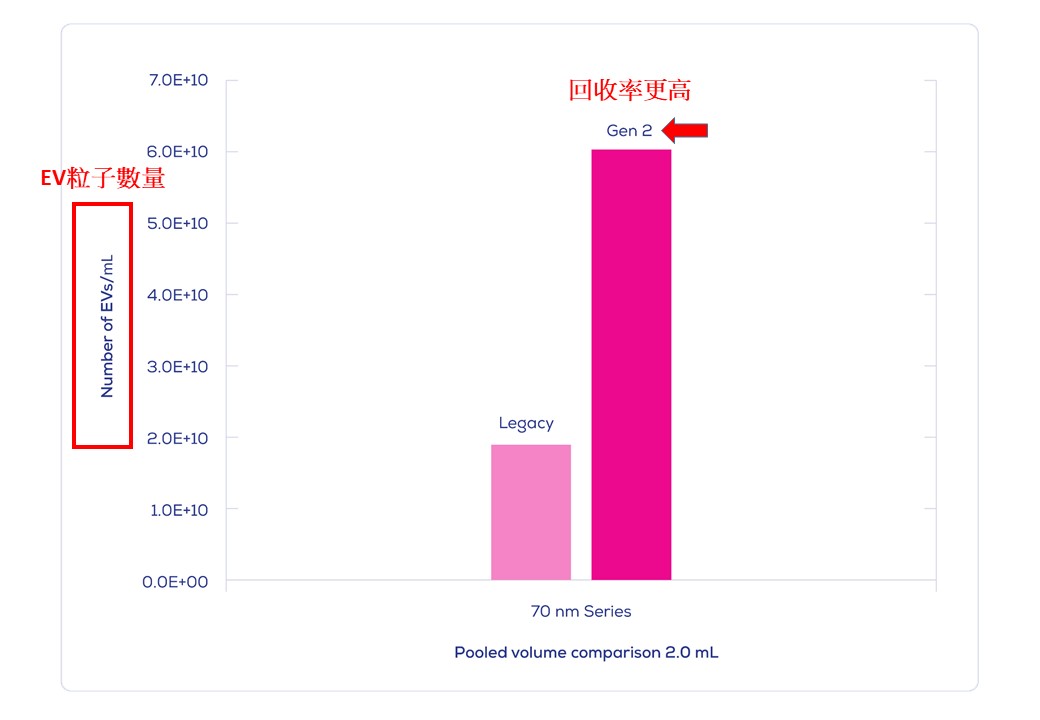
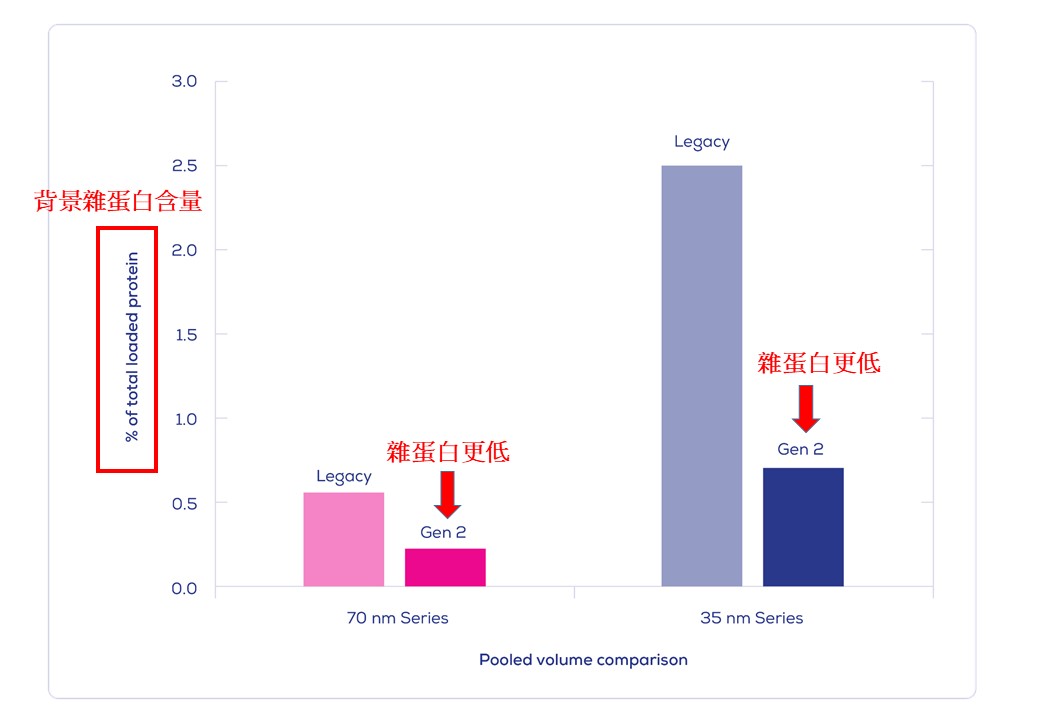
最新的獨家瓊脂糖樹脂填充配方(Gen 2), 大幅提升外泌體純度與回收率
-
最新推出"GMP Ready"管柱, 可得到符合內毒素/生物負荷度的外泌體粒子標準
 |
近年來, 胞外體/細胞外囊泡(Extracellular vesicles, EVs)的研究越來越引起相關生物學者的關注, 因為它們可擔任細胞間訊息傳導的角色: 包含免疫調節、細胞的活化與凋亡誘導以及在疾病狀態下的改變, EVs 的內容物有外泌體(Exosome, 外泌體/胞泌體)、微囊泡(Microvesicles)、外吐小體、胞外小體等。 還在用傳統的純化提取方法嗎? 傳統會使用的高速離心法(UC)或沉澱原理的試劑組(Precipitation Reagent Kits)常會遇到一些問題, 比如超高速離心的過程很花時間, 在 200,000 x g 的作用力下常會破壞囊泡或使囊泡團聚而影響後續的分析, 而使用密度梯度離心法 (Density gradient centrifugation, DGC) 會需要很昂貴的設備也很費時。 另外一個是目前市面上以沉澱原理的試劑組通常是基於PEG高分子聚合物而對沉積外泌體有選擇性, 但相關文獻早已指出這些試劑的成分很大可能會引起蛋白質、脂蛋白和其他生物成分的共沉澱現象出現, 等於是把雜質一起沉澱下來而大幅降低EV的純度值。 |
qEV尺寸排阻色譜分離管柱與其他方式的比較
過程快速, 不需使用任何試劑(reagent)或高速離心的動作, 只用PBS直接自然滴落, 超高純度的完整保留粒子原始性, 臨床醫藥表現可防止免疫副反應出現
| 原理 | 提取方式 | 內容評價 |
| UC超高速離心法 | 經由持續高速沉降或密度梯度差異提取 | 非常耗時, 設備昂貴, 人為操作變數大 |
| PEG共沉澱法 | 利用高分子聚合物PEG將EV共同孵育後沉澱 | 專一性差, 會連同背景雜蛋白一起提取, 純度不佳 |
| 磁珠法 | 使用礠性親合方式結合EV後提取 | 磁珠也會和細胞碎屑結合, 形成干擾 |
| 抗體法 | 利用特定抗體與EV結合後提取 | EV表面有多種的蛋白抗體, 特定抗體只會得到帶有此抗體的某些EV粒子 |
| SEC, 尺寸排阻色譜法(qEV) | 利用粒徑差異透過自然滴落得到EV粒子 | 只有qEV獲得ISO13485認證, 任何人都可以用AFC-V2自動化機台快速的得到高重複且高純度的EV/外泌體奈米粒子 |
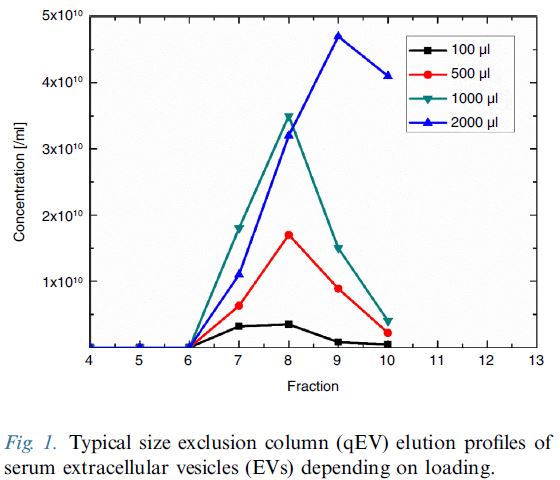
根據國際細胞外囊泡學會ISEV旗下權威JEV期刊發表的"對細胞上清液與人類血漿優化的外泌體提取方案": Richard J. Lobb et al. "Optimized exosome isolation protocol for cell culture supernatant and human plasma", Journal of Extracellular Vesicles 2015, 4: 27031 - http://dx.doi.org/10.3402/jev.v4.27031, 比較了qEV(SEC法), ExoQuick(PEG法), Exospin(PEG法), 並以TRPS技術分析粒徑濃度及BCA法測定蛋白背景純度, 得到結論為qEV是純度最好的方法, 這對於Exosome/EV外泌體的提取要求最為關鍵。
 |
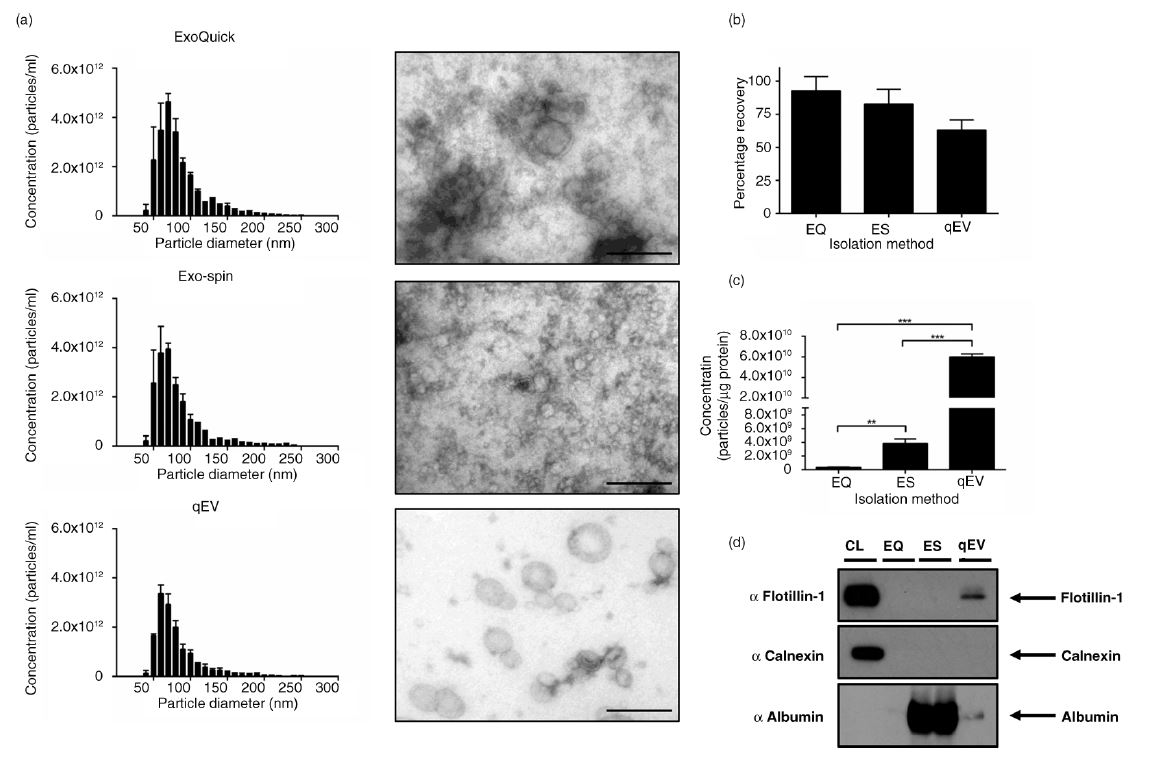 |
SEC 尺寸排阻色譜法
MISEV指南: 相對容易的使用方式, 可乾淨有效的分離EV粒子和背景雜蛋白粒子, 搭配AFC-V2自動系統就可減少人為之間的誤差
|
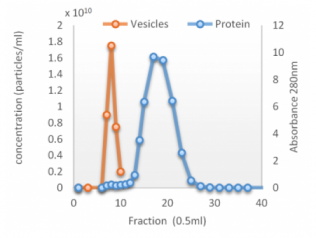
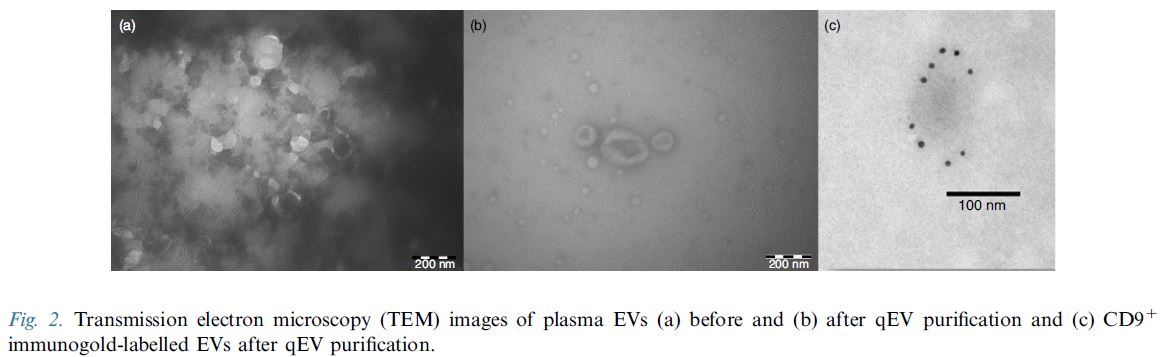
qEV columns 是基於 SEC (Size Exclusion Chromatography) 尺寸排阻色譜法, 又名凝膠過濾法(Gel Filtration) - 可提供快速簡單而精準有效的外泌體提取方式, 以"自然滴落"的方式在15分鐘內即可提取完整的外泌體純樣, 大粒徑的粒子會先流出, 相對的小粒徑粒子(20nm, 35nm或70nm以下)會進入到孔洞內而較晚流出, 比傳統的高速離心 (UC) 或沉澱試劑 (Precipitation Reagent Kits) 的方式更加能純淨、簡單、快速、精確而無損的提取外泌體粒子。 適合後續的下游分析例如Tunable Resistive Pulse Sensing, Electron Microscopy, Proteome or Transcriptome Analysis, 搭配 qEV Concentration Kit 和 qEV RNA Extraction Kit 更是串聯一體化的流程。
qEV columns 依照進樣體積的不同已經有 6 個型號 (150µL - 100mL), 每個型號都有20奈米、35奈米和70奈米共三種孔徑可以選擇, 可完全覆蓋您的原始樣品類型, 使用 PBS 或是其他生理緩衝液洗脫管柱後可重複使用, 現在, qEV 還可以選擇全球第一的自動餾份收集裝置 (AFC-V2, Automatic Fraction Collector)。
10-15分鐘完成提取 -- MISEV國際規範描述: 以尺寸為基礎來分離粒子且操作簡單的方式, 擁有更高的重複度結果
|
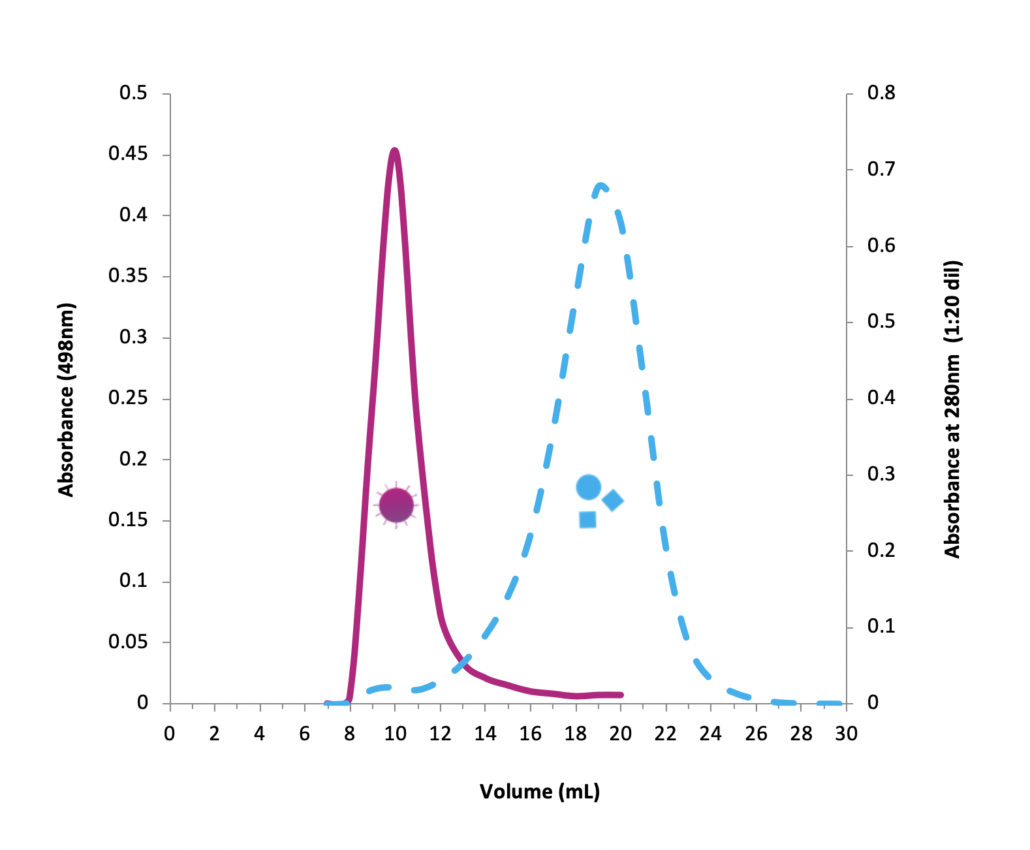 |
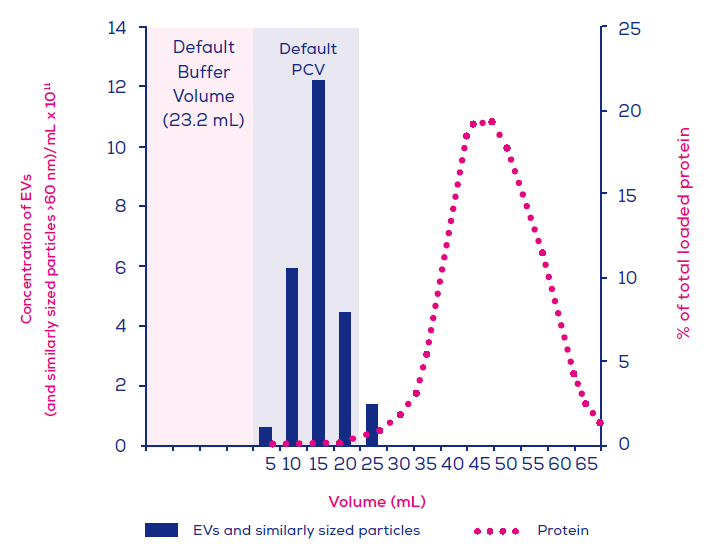 |
 |
各種來源的生物樣品都適用: 血清、血漿、唾液、尿液、乳液、細胞培養上清液、CSF腦脊髓液、生物反應器等
最好的SEC純化管柱, 現在就選擇最新"Gen2"版本的qEV column吧
最新獨家改良型 Agarose resin 瓊脂糖樹脂填充物
 |
IZON Science最新的 "Gen 2" qEV 外泌體尺寸排阻色譜分離管柱, 製造過程符合ISO13485認證, 可得到非常純淨的外泌體/細胞外囊泡粒子, 以10mL人類血漿樣品量為例: 純度可高達約1.0E+10個粒子/每µg背景雜蛋白(相當於1.0E+13個粒子於每mg的背景雜蛋白中), 相較之前舊版的 Legacy qEV 版本具有更為優化的表現, 可移除>99%的背景可溶性蛋白物。
 |
 |
 |
標準化流程 + 自動提取有了 AFC-V2 外泌體自動餾份收集機, 可同時平行準確無誤的放大產出體積 |
生產過程品質可靠證明符合 ISO 13485:2016 醫療器材品質管理系統規範 |
|
|
|
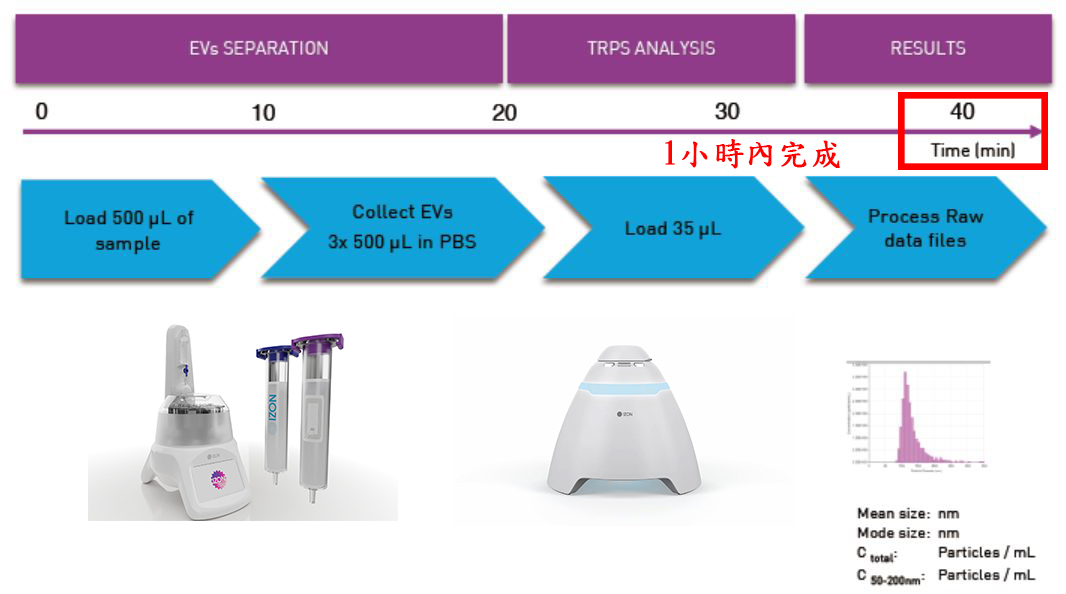
Exosome 外泌體的國際金標準全面解決方案: qEV(SEC) + AFC(Auto) + Exoid(TRPS) is now the Gold Standard for exosome/EV isolation
從樣品的提取開始到定量分析結束, qEV(SEC) + AFC(Auto) + Exoid(TRPS)系統只要一小時內就可以完成, 是國際研究規範 MISEV 推薦的高純度+高解析度的標準化方式
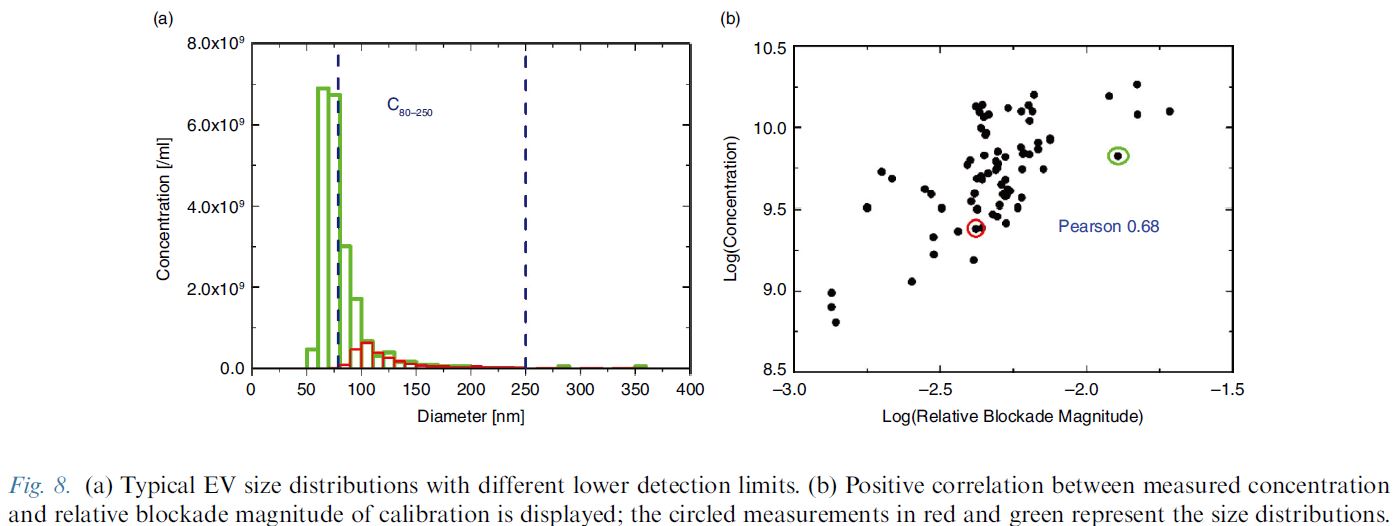
根據國際細胞外囊泡學會ISEV旗下權威JEV期刊發表的"一個使用TRPS可調式電阻脈衝感應決定細胞外囊泡濃度的標準方式": Robert Vogel et al. "A standardized method to determine the concentration of extracellular vesicles using tunable resistive pulse sensing", Journal of Extracellular Vesicles 2016, 5: 31242- http://dx.doi.org/10.3402/jev.v5.31242, 使用了qEV(SEC)和TRPS奈米粒徑分析定量, 是標準且精確符合Exosome/EV外泌體研究的國際規範內容。
 |
 |
 |
 |
如何選擇您的 qEV Gen 2 column 外泌體尺寸排阻色譜管柱? 只需三個步驟
第一步 : 依照樣品的體積 (Sample Loading) 選擇適合的型號
(*如原樣為細胞上清液, 需要先以 100 kDa Concentrator / TFF system 濃縮 30X-200X 的體積, 可提升數量濃度 & 降低qEV成本, 詳見"外泌體實驗知識與流程-如何從細胞上清液提取高純度的胞外體"或參閱對照表):
| qEVsingle (150 µL) |
 |
|
|||
| qEVoriginal (500 µL) |
 |
|
|||
| qEV1 (1 mL) |
 |
|
|||
| qEV2 (2 mL) |
 |
|
|||
| qEV10 (10 mL) |
 |
|
|||
| qEV100 (100 mL) |
 |
|
|||
| 樣品類型 | 樣品特徵 | 樣品體積 | 適合的qEV類型 | 樣品製備方案 |
| 細胞上清液(CCM) & 尿液(Urine) | 大體積、低背景蛋白、低EV含量 | 150-1000 mL | qEV10 |
|
| 血漿和血清 | 變動的體積量、高背景蛋白、高EV含量 | 1-50 mL | qEV1 / qEV2 / qEV10 |
|
| 低黏度生物性流體 | 低體積、變動的EV和背景蛋白量 | 0.1-0.5 mL | qEVsingle / qEVoriginal |
|
| 黏稠的生物性流體 | 低體積、變動的EV和背景蛋白量 | 0.1-0.5 mL | qEVsingle / qEVoriginal |
|
第二步: 選擇 20 nm、35 nm 或 70 nm 的孔徑
| qEV 孔徑種類 | 最佳的回收範圍 | 說明 | ||
| qEV / 20 nm |  |
20-100 nm | 粒徑下限最小; 適合Exomeres/Supermeres外泌超小體和AAVs腺相關病毒粒子 | |
| qEV / 35 nm |  |
35-400 nm | 適合提取小EVs, 外泌體粒子 | |
| qEV / 70 nm |  |
70-1000 nm | 粒徑範圍廣, 適合提取整體EVs/細胞外囊泡的粒子, 數量濃度較多 | |
第三步: 下游的WB, MS, qPCR分析?
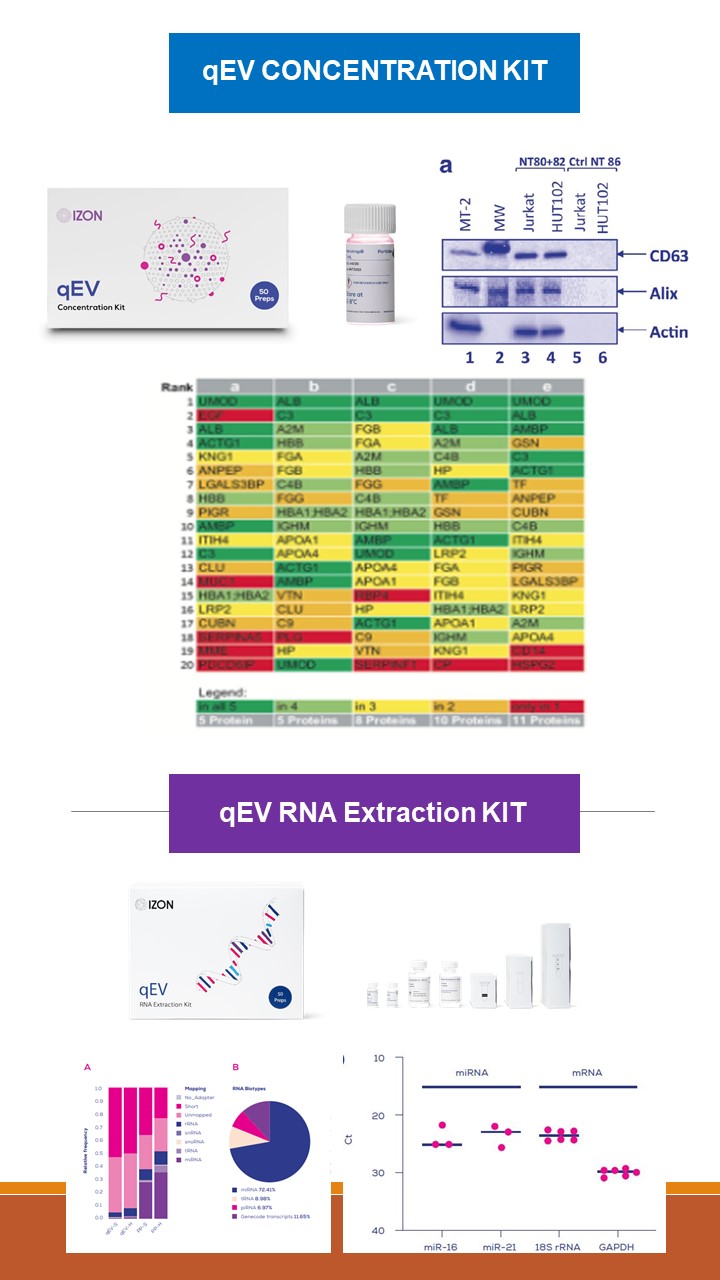
1. 需要做蛋白分析? 繼續使用 "qEV Concentration Kit"
|
3. 直接做粒徑分析? 那就使用最精準的 "Exoid (TRPS) 奈米粒徑/濃度/Zeta potential 膜電位分析儀" .JPG) |
| Gen 2 型號 | 貨號 | 進樣體積 | 使用方式 | 每盒數量(支) | AFC-V2自動餾份收集機 |
| qEVsingle / 20nm | ICS-20 | 150 µL | 單次 | 20 | V |
| qEVsingle / 35nm | ICS-35 | V | |||
| qEVsingle / 70nm | ICS-70 | V | |||
| qEVoriginal / 20nm | ICO-20 | 500 µL | 洗脫後可重複, 建議5次 | 5 | V |
| qEVoriginal / 35nm | ICO-35 | V | |||
| qEVoriginal / 70nm | ICO-70 | V | |||
| qEV1 / 20nm | IC1-20 | 1 mL | 洗脫後可重複, 建議5次 | 5 | V |
| qEV1 / 35nm | IC1-35 | V | |||
| qEV1 / 70nm | IC1-70 | V | |||
| qEV2 / 20nm | IC2-20 | 2 mL | 洗脫後可重複, 建議5次 | 2 | V |
| qEV2 / 35nm | IC2-35 | V | |||
| qEV2 / 70nm | IC2-70 | V | |||
| qEV10 / 20nm | IC10-20 | 10 mL | 洗脫後可重複, 建議5次 | 1 | V |
| qEV10 / 35nm | IC10-35 | V | |||
| qEV10 / 70nm | IC10-70 | V | |||
| qEV100 / 35nm | ICO-35-100 | 100 mL | 洗脫後可重複, 建議5次 | 1 | X |
| qEV100 / 70nm | ICO-70-100 | X |
| 樣品類型 | 樣品特徵 | 樣品體積 | 適合的qEV類型 | 樣品製備方案 |
| 細胞上清液(CCM) & 尿液(Urine) | 大體積、低背景蛋白、低EV含量 | 150-1000 mL | qEV10 | -初步離心樣品以去除細胞、碎屑和大EV粒子 -前濃縮樣品至10 ml -使用qEV10(如果需要可進行流洗後重複使用) -如果需要, 則將EV fractions合併後進行濃縮 |
| 血漿和血清 | 變動的體積量、高背景蛋白、高EV含量 | 1-50 mL | qEV1 / qEV2 / qEV10 | -初步離心樣品以去除細胞、碎屑和大EV粒子 -使用qEV1或qEV2或qEV10 -如果需要, 則將EV fractions合併後進行濃縮 (如為高背景蛋白的樣品則不應該進行前濃縮步驟) |
| 低黏度生物性流體 | 低體積、變動的EV和背景蛋白量 | 0.1-0.5 mL | qEVsingle / qEVoriginal | -初步離心樣品以去除細胞、碎屑和大EV粒子 -使用qEVsingle或qEVoriginal -如果需要, 則將EV fractions合併後進行濃縮 |
| 黏稠的生物性流體 | 低體積、變動的EV和背景蛋白量 | 0.1-0.5 mL | qEVsingle / qEVoriginal | -將樣品懸浮於PBS內以降低黏度 -初步離心樣品以去除細胞、碎屑和大EV粒子 -使用qEVsingle或qEVoriginal -如果需要, 則將EV fractions合併後進行濃縮 |
| 濃縮前的CCM體積範圍 | 濃縮後的CCM體積 / 濃縮倍率 | qEV的選擇 | 使用的濃縮裝置 |
| < 15 mL | 150 µL / 100 x | qEVsingle | 100 kDa 離心過濾管 |
| 15 - 100 mL | 500 µL / 30 x - 200 x | qEVoriginal | |
| 50 - 200 mL | 1 mL / 50 x - 200 x | qEV1 | |
| 100 - 300 mL | 2 mL / 50 x - 150 x | qEV2 | 100 kDa TFF 切向流裝置 + 離心過濾管 |
| 300 - 1000 mL | 10 mL / 30 x - 100 x | qEV10 | |
| 4 - 5 L | 100 mL / 40 x - 50 x | qEV100 |
1. 使用 qEV Columns 提取 Exosome/EVs 時需要做什麼前置作業嗎?
Ans: 採用SEC尺寸排阻色譜法的qEV Columns在使用前只需注意要先將樣品進行兩次步進的低速離心 - 1,500g/10mins, 將上清液移至新的離心管後, 再使用10,000g/10mins離心後取上清; 以上的目的是要去除樣品內的細胞碎屑或其他的大粒子, 之後即可放入 qEV Gen 2 columns 以自然滴落的方式得到Exosome/EVs的餾分(fractions)。
2. 已經使用過的qEV Columns要怎麼封存/保存呢? 所使用的Buffer有什麼注意事項呢?
Ans: 新的qEV Gen 2 olumns內含<0.1% ProClin 200用做抑菌劑 (with PBS)所以可於室溫下保存/運輸; 而已使用過並洗脫後的qEV column, 封存方式有三種:
方法1. 以0.05% w/v sodium azide或0.05% w/v ProClin 200(with PBS)封存, 可在室溫保存; 下次使用時一樣要先做"equilibrate"平衡的動作, 以2倍column體積的Buffer流洗管柱。
方法2. 以20% ethanol封存, 可在室溫保存; 因PBS如果直接接觸乙醇會形成結晶而堵塞管柱, 所以要先以DI water流洗2xcolumn volume後再放入乙醇, 下次使用前一樣要先用去離子水流洗後再放入PBS buffer做平衡。
方法3. 如只加入PBS封存, 則建議放4-8度冷藏下保存(不可冷凍); 但一定需要注意PBS要經過degas & filtered, 避免下次取出在室溫下時因為溫差而析出小氣泡於管柱內影響使用。
請注意, 實驗過程中所用到的PBS buffer都應經過0.22um filtered & Degas除氣(可使用負壓泵接錐形瓶形成管路的負壓系統抽氣, 或退其次以超音波震盪15分鐘以上), 以避免在column的resin中析出氣泡。
3. 我的細胞上清液原樣體積很大, 該使用何種 qEV Columns 呢?
Ans: 細胞上清液(Cell Culture Media, CCM)需要先進行濃縮體積後再過qEV column來純化提取EVs, 濃縮的倍率可規劃在20x-200x之間; 比如CCM體積如有15-100 mL, 就可以濃縮到500 µL後過qEVoriginal Gen 2 column; CCM體積範圍最大一次可達4-5L, 將其濃縮到100 mL後再過qEV100 Gen 2 column。
CCM體積若是在200 mL以下, 就使用100 kDa離心濃縮管來濃縮; CCM體積若是在200 mL以上, 就使用TFF(切向流過濾, 100 kDa)來濃縮, 相關流程請參閱外泌體實驗知識與流程-如何從細胞上清液提取高純度的胞外體
4. CCM細胞上清液的體積濃縮倍率, 計畫的低倍率或是高倍率有什麼影響?
Ans: 濃縮倍率可規劃在30x-200x之間; 如果濃縮倍率太低, 好處是可以節省離心濃縮的時間和離心濃縮管的使用數量, 但純化提取後得到的EVs粒子濃度會比較少, 以致後續的下游實驗無法得到明顯的結果; 如果濃縮倍率太高, 好處是確保純化提取到的EVs粒子濃度足夠, 但要小心若是濃縮的上清液的"黏度"(vescosity)太高, 代表背景雜蛋白濃度非常高, 會導致qEV管柱的孔隙被過高濃度的雜蛋白粒子堵塞。
5. 經由qEV column後的fractions, 要如何做下游測試例如Western 西方墨點法? 可否每個fraction單獨進行?
Ans: 因為qEV是以SEC原理進行純化, 可區分為EV zone和非EV zone; 流洗出的總體積會比原樣還大, 代表需要經過後製濃縮(使用qEV Concentration Kit)才會得到有把握的分析結果。
qEV column的elution洗脫曲線中所設定的fraction, 是用來設計EV zone為"純度"、"回收率"或"濃度"為考量的微調設定, 不可直接以單獨單一的fraction進行下游WB分析來比較, 而是需要將設計的EV zone先做"合併餾份(pooled fractions)", 再經由qEV Concentration Kit進行濃縮富集EVs成"pellet"後再開始WB分析。







.JPG)
.JPG)
.jpg)