最新消息
2023-03-19
[純度很重要:為什麼不同的胞外體EV分離純化方法會產生不同的結果]
Source: https://www.izon.com/news/purity-matters-why-different-ev-isolation-methods-give-different-results
簡介:您是否想知道, 改變純化的方法是否會影響檢測到的EV分離物的生物活性, 或者甚至是他們的裝載貨物或標記?閱讀下面的內容, 你就會知道這就是為什麼。
方法很重要: 更改工藝流程中的任何一件事都可能會完全改變您的結果。這對於胞外體(EV)分離和其他技術來說都是如此, 但這對您的研究意味著什麼呢?
為了討論這個問題,我們將Kronstadt 等人(2022)發表的文獻作為一個案例研究。通過他們的案例, 深入探討了他們的結果的細節, 並討論您的EV分離純化中可能存在污染的原因和存在方式。
友情小提示:與其他技術相比, 使用qEV Gen 2 尺寸排阻柱可以顯著減少背景污染物!
-
您如何確定 EV分離物的生物活性是否取決於EV本身?
為了解答這個問題, Kronstadt等人(2022) 使用了可靠的HEK293T 細胞。然後分別使用超速離心(UC)、切向流過濾(TFF) 、qEVoriginal 35 nm Series Gen 2尺寸排阻管柱將EV分離純化出來。首先他們發現, 無論採用哪種技術, EV粒徑大小在統計上都沒有變化(下圖)。

圖1. 通過超速離心(UC)、切向流過濾(TFF) 和 qEV Gen 2尺寸排阻管柱從培養瓶中培養的HEK293T 細胞中分離出的胞外體的大小。虛線代表mode粒徑, 而周圍的實心區域代表誤差。改編自 (Kronstadt et al. 2022)。
這個研究接下來調查了抑制小鼠巨噬細胞中脂多糖(LPS)誘導的炎症的能力。在這裡, 需要特別注意的是HEK293T細胞不會釋放抗炎EV。
為了進一步測試是否可以檢測到錯誤的生物活性, 作者研究了三種細胞因數/趨化因數的分泌, 並進行了各種實驗以瞭解任何抑制特性的來源。他們運用ELISA檢測細胞因數/趨化因數的分泌。
-
活性EV成分或FBS污染物?
當應用於巨噬細胞時, 使用三種技術分別獲得的EV分離物都導致了LPS引發IL-6 分泌的抑制現象。因此, 似乎結論是IL-6 分泌的抑制因數可能是基於EV的。 但是, 由於新鮮培養基與HEK293T 條件培養基同樣能夠抑制IL-6, 所以此抑制因數也可能來自培養基而非HEK293T細胞(圖2)。具體來說, 它可能來自胎牛血清(FBS) (圖2B)。
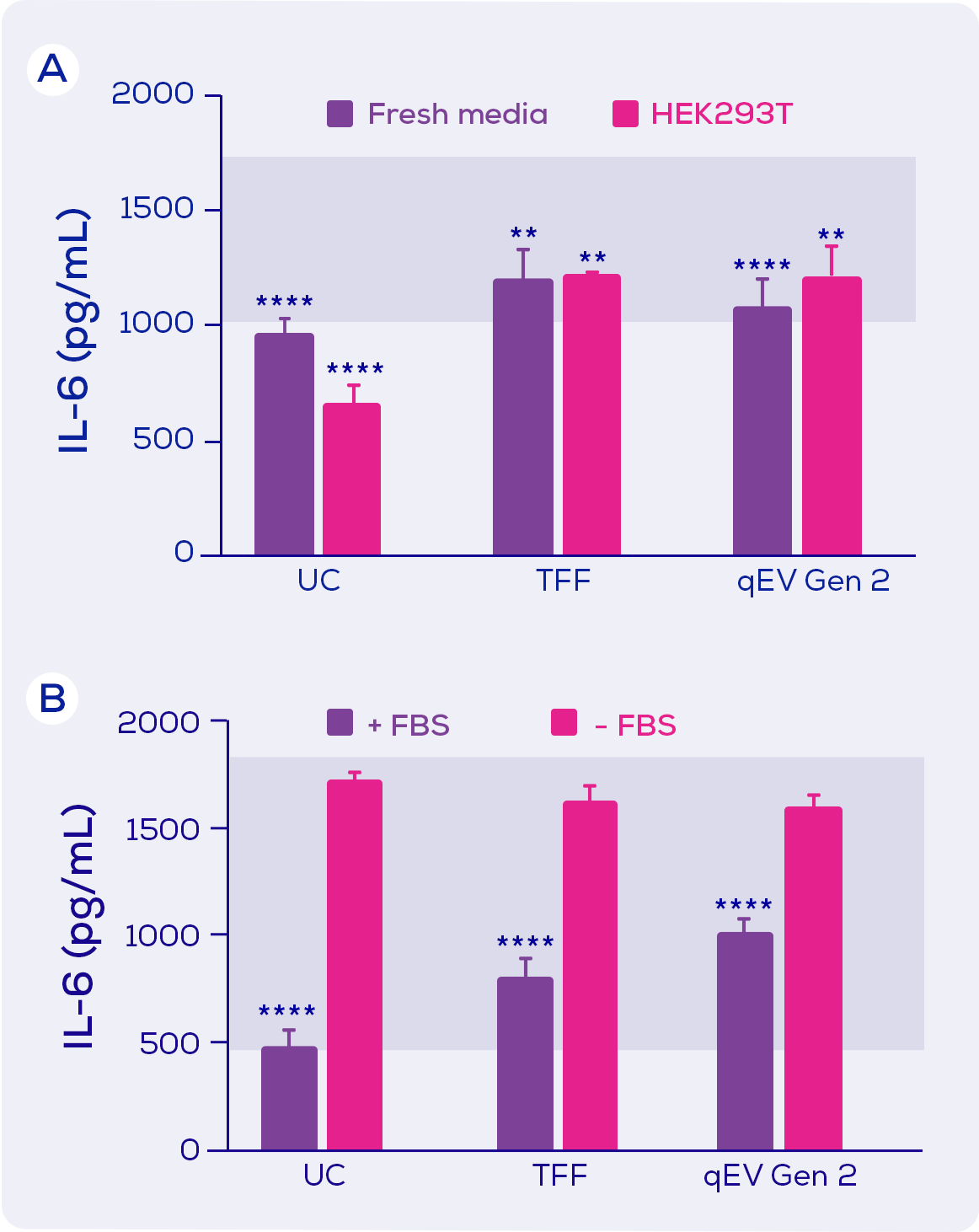
圖2. LPS誘導的小鼠巨噬細胞的IL-6分泌。小鼠巨噬細胞暴露於LPS , 和分別使用超速離心(UC)、切向流過濾(TFF)或 qEV Gen 2 尺寸排阻管柱進行EV分離的新鮮培養基(±胎牛血清; FBS)或HEK293T條件培養基(+ FBS)。藍色陰影區域代表暴露於LPS的最大分泌量和暴露於LPS加上一種抑制劑的最小分泌量。統計結果由Tukey post hoc test的雙向方差檢測。** = p<0.01;**** = p<0.0001。改編自Kronstadt 等人(2022)[1].
在研究LPS引起的RANTES分泌(一種趨化因數)時, 只有UC分離純化(以及在另外一些實驗中, TFF)導致分泌的抑制。由於與qEV分離純化相比, UC與更大程度的可溶蛋白質污染相關。因此這種情況下, 對RANTES的抑制因數可能是可溶性蛋白質。與IL-6抑制一樣, 實驗表明對RANTES的抑制因數似乎來自培養基中的FBS, 而不是細胞本身(圖3)。
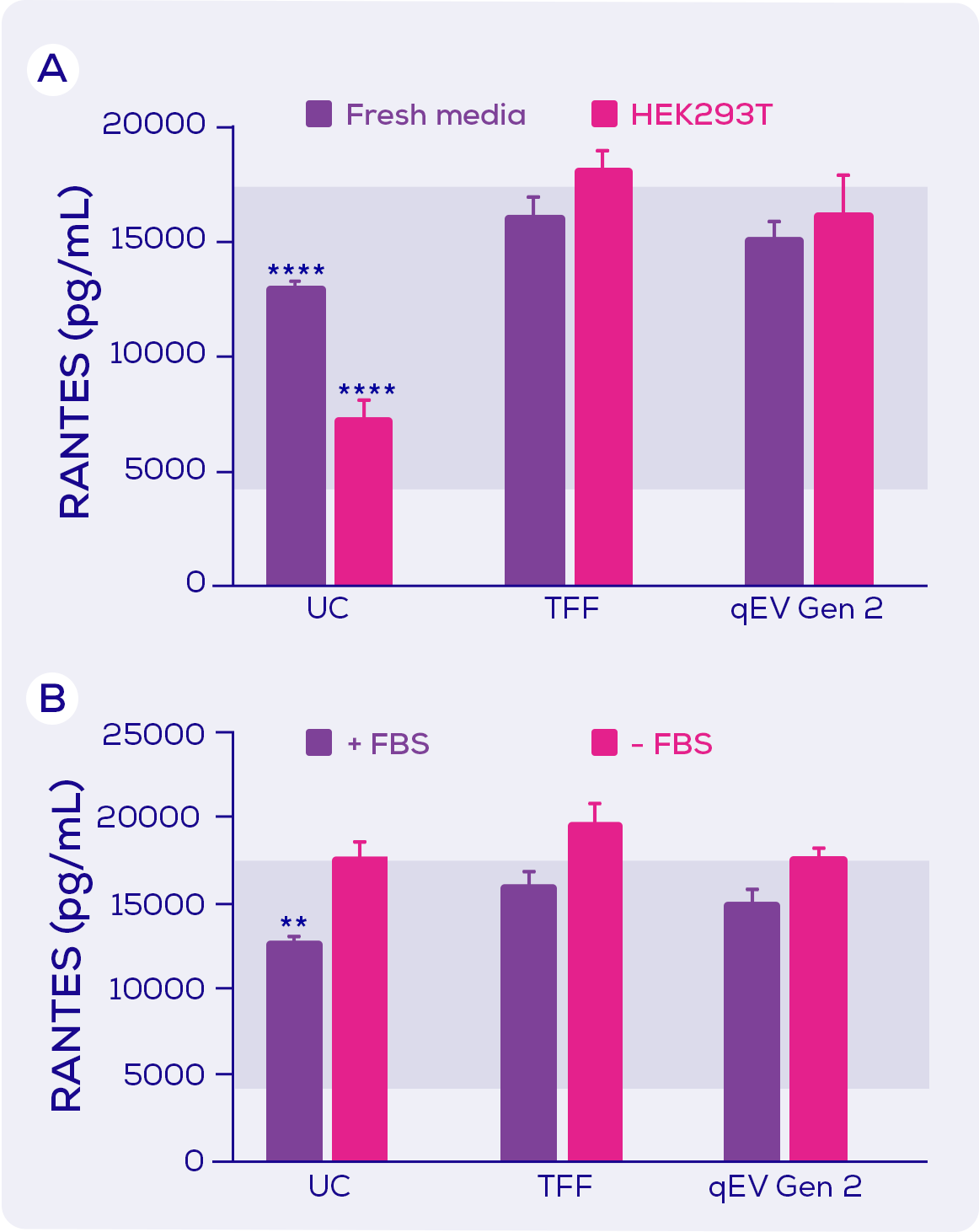
圖3. 暴露於 LPS 的小鼠巨噬細胞RANTES的分泌。小鼠巨噬細胞暴露於LPS , 和分別使用超速離心(UC)、切向流過濾(TFF)或qEV Gen 2尺寸排阻管柱進行EV分離的新鮮培養基(±胎牛血清; FBS)或HEK293T條件培養基(+ FBS)。藍色陰影區域代表暴露於LPS的最大分泌量和暴露於LPS加上一種抑制劑的最小分泌量。統計結果由Tukey post hoc test的雙向方差檢測。** = p<0.01; **** = p<0.0001。 改編自Kronstadt 等人(2022)[1].
最後, 對於TNF-α, 只有TFF(在另外一些實驗中, UC)分離出TNF-α分泌的抑制因數。 該抑制因數似乎存在於新鮮培養基中, 並且在更大程度上存在於HEK293T 條件培養基中(圖4)。
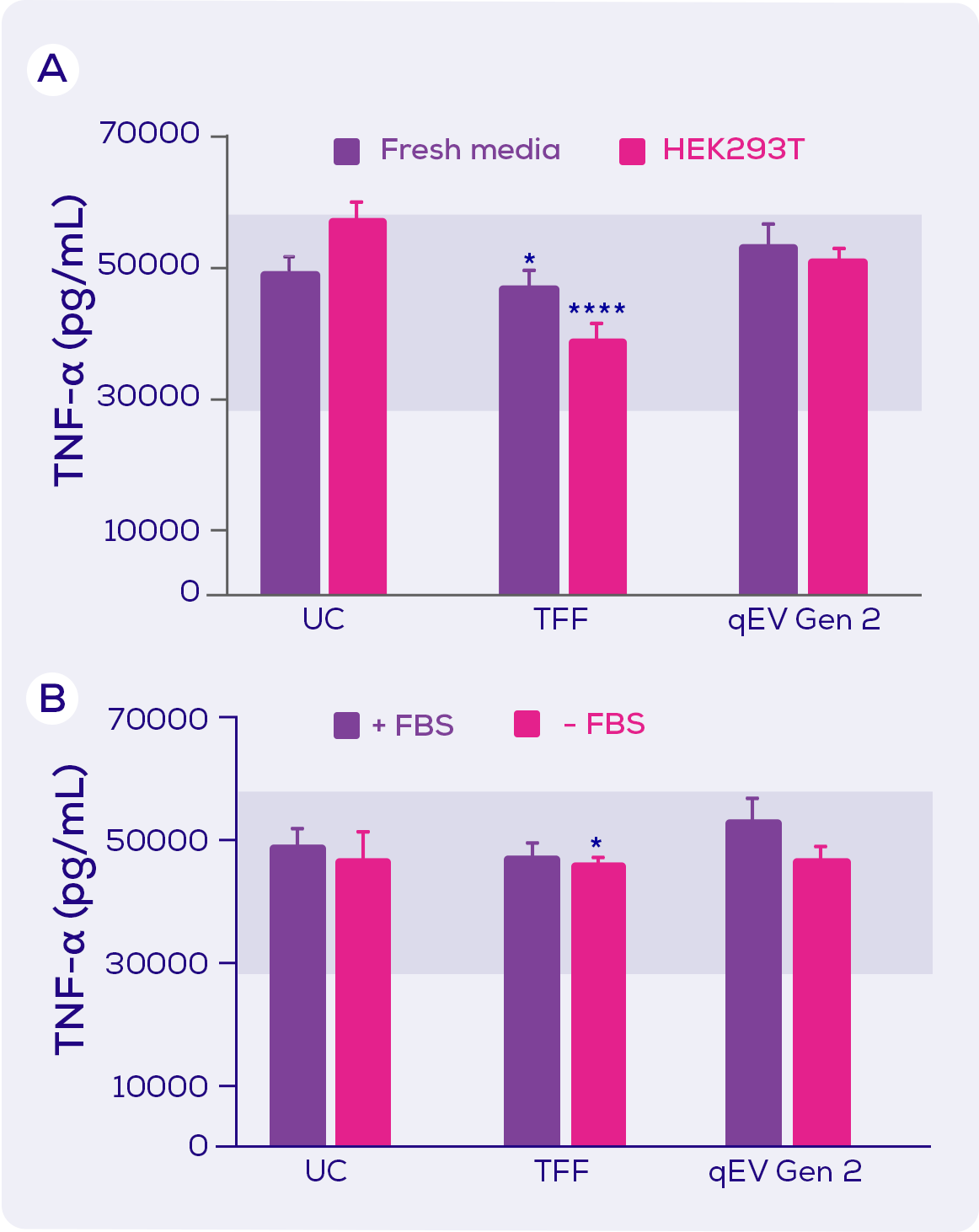
圖4. 暴露於 LPS 的小鼠巨噬細胞的TNF-α分泌。小鼠巨噬細胞暴露於LPS , 和分別使用超速離心(UC)、切向流過濾(TFF)或qEV Gen 2尺寸排阻管柱進行EV分離的新鮮培養基(± 胎牛血清; FBS)或HEK293T條件培養基(+ FBS)。 藍色陰影區域代表暴露於LPS的最大分泌量和暴露於LPS加一種抑制劑的最小分泌量。 統計結果由Tukey post hoc test的雙向方差檢測。 * = p<0.05;**** = p<0.0001。 改編自Kronstadt 等人(2022) [1].
總結
總體而言, 很明顯, 使用SEC (文中qEV Gen 2管柱)分離EV可提供純淨的EV分離物, 與UC或TFF相比, 它大大降低了非EV來源的污染。分離方法越純粹, 分離中出現非EV的可能性就越低。
然而, 作者還強調了使用FBS 時的一個重要考慮因素。FBS 應添加到培養基中, 然後使用UC法去除EV。無論分離方法有多好, 它都無法區分您希望樣本中出現的EV和樣本中不希望出現的其他來源的EV。
這對您的EV分離意味著什麼?
您可能剛剛更改了EV分離純化流程(或者您可能正在考慮這樣做)並且看到了與以前不同的結果。雖然這非常令人沮喪, 但瞭解此更改的原因很重要。運用qEV Gen 2系列, 我們能比以往提高EV分離純化的純度。正如您在圖 5中所見, Gen 2系列具有明顯更高的EV與雜蛋白質比率, 該比率通常用於EV 領域作為純度的衡量標準。憑藉可提供如此的高純度和快速且可反復的分離純化方法, 相信您已經有很多理由選擇qEV Gen2尺寸排阻管柱進行EV分離純化。
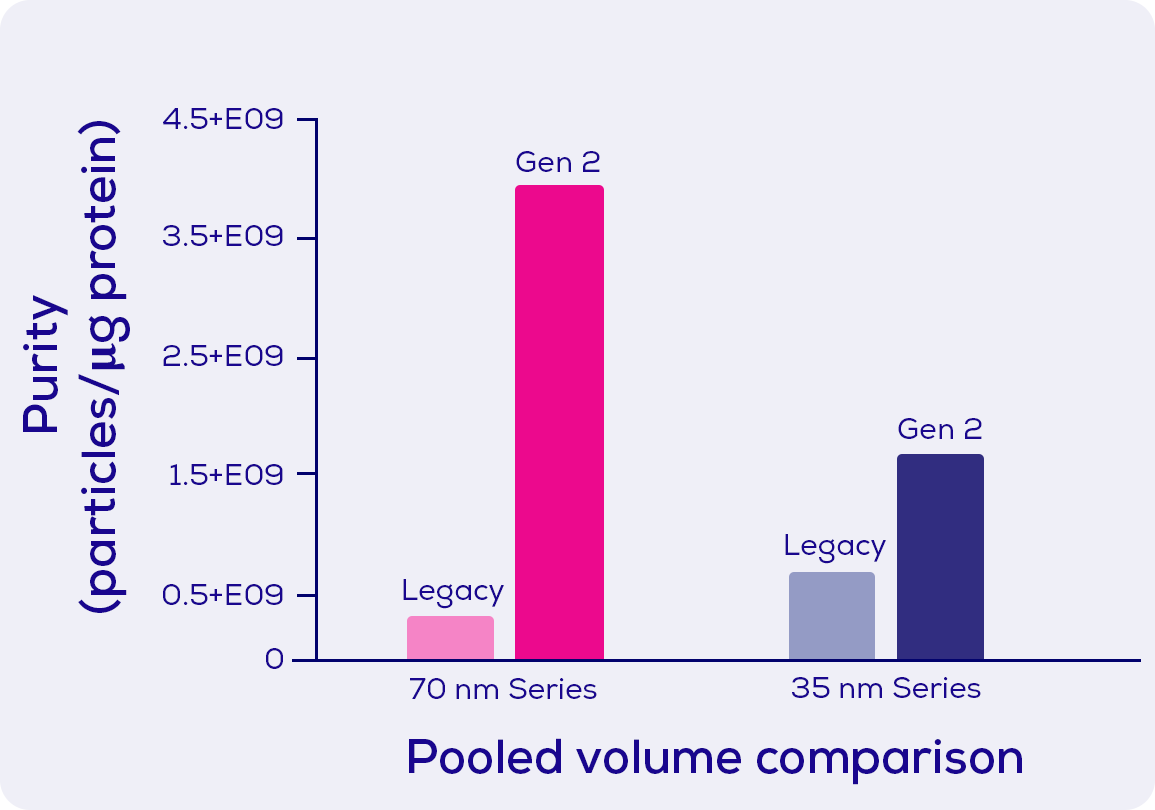
圖5. 每微克雜蛋白質的胞外體(EV) 數量, 分別通過可調式電阻脈衝感應技術(TRPS)和二辛可寧酸測定法(BCA)測量。 顯示了使用IZON的AFC-V2(胞外體自動提取機)和 70 nm/35 nm 系列的 qEVoriginal Gen 2尺寸排阻管柱(0.5 mL 上樣體積)分離的人血漿樣品的資料(來源於IZON原廠資料)。
與第一代Legacy尺寸排阻管柱或其他方法相比, 現在的Gen 2提純技術可能會改變您對EV的認識。更棒的是, 這也可能會改變一些實驗假設!當然, 改變你的假設是乏味的, 但最終它是一件好事。這意味著你現在比以前更正確。我們對科學中“真實”的看法總是隨著方法的改進而改變。站在精度革命的最前沿, 並通過今天的qEV Gen 2 尺寸排阻管柱改進EV的分離純化。IZON最新的Gen 2尺寸排阻管柱現已全面上市, 適用於150 µL至100 mL的樣品量, 您甚至可以以折扣價批量購買!
如果您需討論 qEV Gen 2尺寸排阻管柱系列如何説明您在EV分離純化中獲得更高的純度, 或查詢批量折扣, 請聯繫我們。
參考文獻
Kronstadt, S. M., Van Heyningen, L. H., Aranda, A. & Jay, S. M. Assessment of anti-inflammatory bioactivity of extracellular vesicles is susceptible to error via media component contamination. Cytotherapy (2023). https://doi.org:10.1016/j.jcyt.2022.12.002
