最新消息
2022-12-25
[關於血漿內的胞外體之蛋白質組學分析: SEC-MS(尺寸排阻-質譜法)]
簡介: 美國Mayo Clinic(Rochester, MN, USA)的研究人員開發了一種優化的血漿內的胞外體(Extracellular vesicles, EVs)的蛋白質組學分析方法, 並已被Cell Reports methods收錄[1]; 此方法使用了qEV column(SEC, Size Exclusion Chromatography尺寸排阻色譜法)胞外體提取管柱和高解析度質譜儀(Mass, MS), 與傳統的方法相比後發現可獲得更深的蛋白質組學覆蓋度與更高的精度和再現性。 胞外體(EVs)中含有的大量蛋白質, 在診斷和預測疾病的潛力是目前研究主要的興趣, 因此需要採用可與下游分析相容的方法以對EVs進行最好的分離純化。 然而在傳統的分離技術例如超高速離心(UC)和沉澱試劑盒(Kit)的方法卻常不相容於下游EVs的蛋白分析, 而且再現性並不好[2-3], 例如: EVs的分離純化過程中會攜帶大量的血漿中的蛋白污染物[4-5], 或者在連續幾輪離心下所導致的EVs產量低下[6], 使得對EVs的蛋白質組學分析受到了影響, 因此作者優化了一個可精確且深入分析EVs蛋白的實驗流程, 並和傳統的EVs分離純化方法相比較的分析性能進行了基準測試, 甚至還運用了運動作為刺激的手段, 證明了SEC-MS檢測迴圈EVs的蛋白質組生理變化的能力。 下圖, Vanderboom等人描述了優化的尺寸排阻管柱分離血漿EVs的蛋白質組學分析方法。該方法可應用於檢測急性高強度有氧運動和低強度抗阻運動的EVs相關蛋白的變化。SEC-MS提供了優異的血漿-EVs的蛋白質組學覆蓋度 利用移除血小板的血漿和幾種不同的測量方法, 比較了不同分離純化技術對EVs-蛋白質組學分析的適用性, 包括: 檢測到的EVs蛋白數量(由ExoCarta資料庫定義[7])和檢測到的典型EVs標記蛋白數量(CD9、CD81、CD63、PDCD6IP、ADAM10、SDCB1、FLOT1、ANXA5、OIT3)。 從這些指標來看, 使用qEV 管柱的SEC-MS優於ExoEasy、UC和ExoQuick三種方法; 例如使用qEV管柱分離純化後可鑒定到400多個ExoCarta蛋白, 而UC法只能鑒定到大約250個(下圖A); 此外與ExoEasy(檢測到3個)、UC(檢測到3個)和ExoQuick(未檢測到)相比, qEV(SEC)可鑒定出9個典型EVs標記蛋白中的8個 (下圖B)。
SEC-MS可用于區分EVs來源的蛋白和污染物蛋白 作者通過評估qEV2/70nm管柱純化的EV zone, 優化了無標記的SEC-MS方法。通過比較EVs的流洗模式, 可將污染物蛋白與EVs的蛋白區分開來: 纖維蛋白原、載脂蛋白B和其他高分子量血漿蛋白相關的流洗曲線分佈呈現右移(下圖A中虛線)。 這種“分佈過濾方式”被擴展到對ECT100(EVs中最常見的蛋白質)的評估中, 絕大多數(79/84)檢測到的ECT100蛋白的分佈跨越了三個qEV2的餾份(F17-F19), 而那些在三個餾份之外的分佈蛋白顯示出的特性表明它們可能來自血漿的雜蛋白而不是來源於EVs (下圖B)。
SEC-MS方法可再現+線性程度高+高精確度 線性、精度和再現性在以下三個方面可得到證明: 1. 通過在三個不同的qEV管柱上處理三重複已移除血小板的血漿樣品, 證明了qEV純化的可重複性; 經鑒定的ECT100和EVs蛋白的流洗圖譜在管柱上也具有高度的重複性如下圖; A. 85個ECT100蛋白均可在三重複中被檢測到。B. 常見的EVs蛋白流洗圖。C. 85個ECT100蛋白的變異係數。D. 四個ECT100的滯後流出也具有重複性。
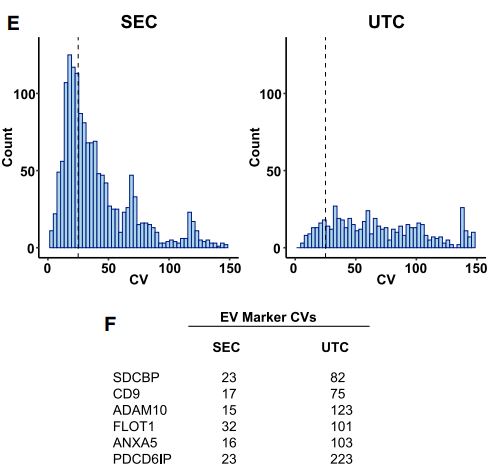
2. 在五重複測試中, 使用qEV鑒定了500多個變異係數CV小於25%的蛋白質, 而UC法僅鑒定出了73個蛋白質。考慮到與該方法相關的覆蓋度不佳[6],UC法相關的高CV值並不令人驚訝, 這是由於該方法未能檢測到蛋白質或檢是測出的蛋白質的強度低於SEC, 如下圖。
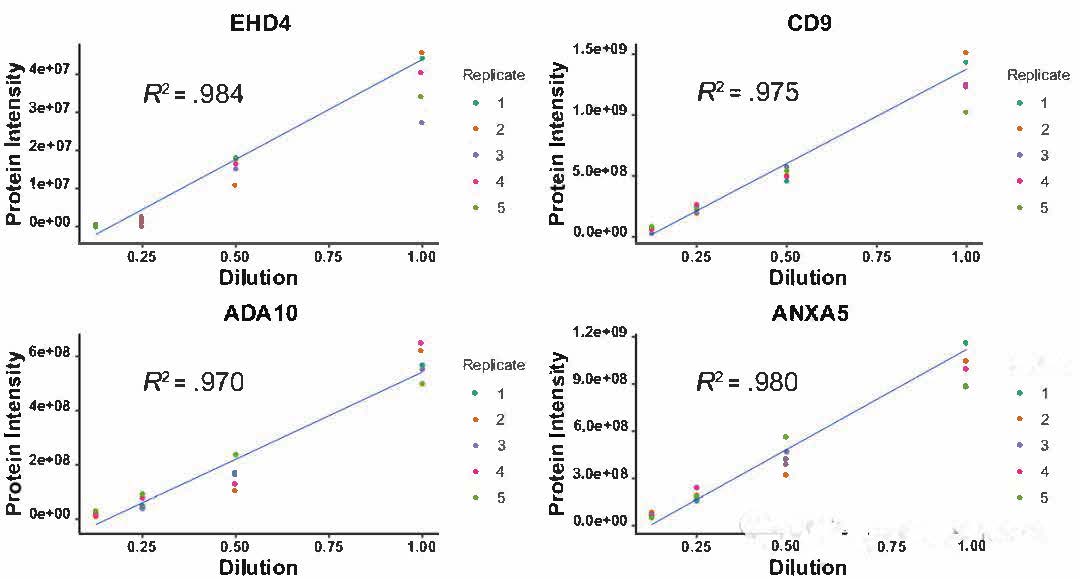
3. 通過在除去外泌體的牛血清中連續稀釋富含血小板的血漿(代表EVs豐度的較高端)(以延長EVs豐度的較低端), 同時評估SEC-MS的重複性和線性。重要的是, EVs蛋白即使在最低的量也能檢測到, 並且在整個動態範圍內可呈線性, 如下圖。
將純化的EVs餾份做合併以進一步優化EVs蛋白質組學分析 與分析單個餾份相比, 合併的EV zone可在蛋白組學分析中得到相似的蛋白圖譜;重要的是, 合併的EV zone可改善EVs的蛋白質強度的變異係數CV, 突出了在qEV中的EV流洗出的可預測性和可重複性。來自不同細胞類型的EVs會含有獨特的EVs蛋白質標記物 為了確定EVs會含有原組織特有的蛋白質, Vanderboom和其同事完成了一系列基於細胞培養的實驗。他們分別培養了原代人肌管、原代人脂肪細胞、Huh7肝細胞、白細胞和分離的人血小板, 並在qEV分離純化EVs後使用MS分析其蛋白。雖然許多鑒定出的蛋白質在所有細胞類型中都是常見的, 但也有不少是每種細胞培養所特有的, 包括18種來自血小板培養的蛋白質; 310種來自白細胞的EVs; 350種來自肌管的EVs; 180種來自肝細胞的EVs; 121種來自脂肪細胞的EVs (下圖A)。這項工作被擴展為開發一種用於追蹤”循環EVs”起源的研究手段; 關於假定的細胞特異性的EVs蛋白的SEC-MS資料與Human Protein Atlas的資料合併, 以查看每個蛋白集是如何相關的。
強調了血小板和白細胞所衍生的EVs 將移除了血小板的血漿與標準血漿來源的純化EVs進行SEC-MS分析(下圖): 1. 與移除了血小板的血漿相比, 在標準血漿中發現了更多的雜蛋白 2. 血小板和白細胞特異性蛋白的豐度在標準血漿中高於已移除血小板的血漿 這些結果為血小板和白細胞體外釋放EVs提供了證據, 並表明了要採取適當的措施以限制這一行為的重要性: 正如國際細胞外囊泡學會(ISEV)和國際血栓與止血學會(ISTH)所闡述的。
SEC-MS的高靈敏度可允許檢測出生理的變化 該研究的最後一項內容涉及到實施生理的干涉步驟, 以確定SEC-MS是否有足夠的靈敏度以檢測EVs蛋白質組的變化。具體來說, 在單次高強度的有氧運動(腳踏車: 4次4分鐘, VO2峰值達到90%, 間隔騎3分鐘的無負荷腳踏車)或抗阻運動(單腿伸展, 3組10次, 每次最多重複70%, 中間休息1分鐘)前後比較EVs的蛋白豐度; 考慮到之前有關於運動會誘導分泌EVs含蛋白的reference[8-9], 此研究選擇急性運動作為刺激方式。 SEC-MS顯示出, 有氧運動後循環EVs的蛋白豐度會顯著增加, 在運動後3小時會回到訓練前的含量, 這是通過測量ADAM10陽性粒子證實的; 粒子數分析是使用奈米顆粒追蹤分析法(NTA)進行, 但NTA沒有檢測到運動後的粒子數會增加, 表示NTA的低解析度與最近幾項生物[10]和合成粒子[11]比較的分析技術的研究結果一致- NTA的解析度遠低於奈米流式細胞術和可調式電阻脈衝感應法(TRPS)。 有超過300種蛋白質會在高強度的有氧運動後顯著增加, 與抗阻運動相比反應明顯更大, 而只有7種EVs蛋白會在運動後上調(下圖C)。這部分研究的目的是確認SEC-MS是否有足夠的靈敏度可檢測出重大生理事件後EVs蛋白質組的變化, 而不是將研究結果與之前的報告進行比較。無論如何, 該小組進行了一些有趣的EVs相關觀察, 強調了EVs蛋白在調節運動代謝和免疫反應中的潛在作用。通過綜合他們之前實驗的細胞培養資料(如上所述), 並利用功能富集分析和獨創性Pathway分析, 可確定了EVs上調蛋白可能的功能作用和組織來源。上調的蛋白包括那些參與血管生成、傷口癒合、中性粒細胞作用、糖酵解,並通過白細胞介素-8和整合素信號轉導。通過綜合基於細胞培養的EVs分析經驗, 該小組確定了運動後立即釋放EVs蛋白的候選組織來源: 包括肌管、肝細胞、脂肪細胞、白細胞和血小板。
SEC-MS是研究EVs的組成和功能的有力工具 本研究證明了在SEC-MS工作流程中利用qEV分離純化技術進行EVs蛋白質組學分析的許多優點。與MS結合UC或基於沉澱試劑盒的分離純化方法相比, SEC-MS可提供來自循環EVs的蛋白質的良好覆蓋度, 使其能夠檢測到更多的蛋白質。由於qEV分離純化是高度可靠和可再現的, 可以通過比較強度的分佈位置來分辨基於血漿和EVs來源的蛋白質。
參考文獻: 1. Vanderboom PM, Dasari S, Ruegsegger GN, et al. A size-exclusion-based approach for purifying extracellular vesicles from human plasma. Cell Reports Methods. 2021;1(3). doi:10.1016/j.crmeth.2021.100055 2. Sidhom K, Obi PO, Saleem A. A Review of Exosomal Isolation Methods: Is Size Exclusion Chromatography the Best Option? International Journal of Molecular Sciences. 2020;21(18):6466. doi:10.3390/ijms21186466 3. Stranska R, Gysbrechts L, Wouters J, et al. Comparison of membrane affinity-based method with size-exclusion chromatography for isolation of exosome-like vesicles from human plasma. Journal of Translational Medicine. 2018;16(1). doi:10.1186/s12967-017-1374-6 4. Bard MP, Hegmans JP, Hemmes A, et al. Proteomic analysis of exosomes isolated from human malignant pleural effusions. American Journal of Respiratory Cell and Molecular Biology. 2004;31(1):114-121. doi:10.1165/rcmb.2003-0238OC 5. György B, Módos K, Pállinger É, et al. Detection and isolation of cell-derived microparticles are compromised by protein complexes resulting from shared biophysical parameters. Blood. 2011;117(4):e39-e48. doi:10.1182/blood-2010-09-307595 6. Livshits MA, Khomyakova E, Evtushenko EG, et al. Isolation of exosomes by differential centrifugation: Theoretical analysis of a commonly used protocol. Scientific Reports. 2015;5(1). doi:10.1038/srep17319 7. Keerthikumar S, Chisanga D, Ariyaratne D, et al. ExoCarta: A Web-Based Compendium of Exosomal Cargo. Journal of Molecular Biology. 2016;428(4):688-692. doi:10.1016/j.jmb.2015.09.019 8. Frühbeis C, Helmig S, Tug S, Simon P, Krämer-Albers E-M. Physical exercise induces rapid release of small extracellular vesicles into the circulation. Journal of Extracellular Vesicles. 2015;4(1):28239. doi:10.3402/jev.v4.28239 9. Whitham M, Parker BL, Friedrichsen M, et al. Extracellular Vesicles Provide a Means for Tissue Crosstalk during Exercise. Cell Metabolism. 2018;27(1):237-251.e4. doi:10.1016/j.cmet.2017.12.001 10. Vogel R, Savage J, Muzard J, et al. Measuring particle concentration of multimodal synthetic reference materials and extracellular vesicles with orthogonal techniques: Who is up to the challenge? Journal of Extracellular Vesicles. 2021;10(3). doi:10.1002/jev2.12052 11. Caputo F, Vogel R, Savage J, et al. Measuring particle size distribution and mass concentration of nanoplastics and microplastics: addressing some analytical challenges in the sub-micron size range. Journal of Colloid and Interface Science. 2021;588:401-417. doi:10.1016/j.jcis.2020.12.039
