最新消息
2022-10-09
[研究分享] L1CAM的爭議: 是否是腦源性-胞外體的標記物?
從循環和腦脊髓液(CSF)中分離腦源性-胞外體(EVs)對於尋找神經系統疾病的生物標誌物非常重要。然而, 其中的標記物-- L1CAM在最近受到了質疑, 在這裡我們討論了支持和反對L1CAM作為神經元EV標記的證據。
什麼是L1CAM?它在哪裡表達?它有什麼作用?
L1細胞粘附分子(L1CAM)是一種膜整合蛋白, 是免疫球蛋白(Ig)超家族的一員。在大腦中, L1CAM參與神經元遷移[1]、髓鞘形成[1]和對損傷作出反應的可塑性 [2]。然而, 儘管L1CAM在很大程度上被認為是一種腦源性細胞粘附分子, 但它在腦外卻也有廣泛的表達。例如單細胞RNAseq分析表明, L1CAM的最大生產者是腎集合管細胞, 其次是皮膚的黑色素細胞[3], 再其次是神經元細胞, 但這也不限於大腦[3]。高度神經支配的組織如胃腸道、內分泌器官和眼睛也表達了大量的L1CAM [3]。L1CAM在幾種癌症中也有高度表達, 並且與預後不良有關 [4,5]。因此循環中的L1CAM可能有健康和疾病方面的眾多來源。
儘管其有著廣泛的表達, 但來自多個小組的許多研究已經使用L1CAM來免疫捕獲循環和CSF衍生的EVs。這些研究報導,這些EVs源自神經元, 並被稱為可為進入大腦提供視窗; 然而, 在過去的幾年中卻出現了關於這種技術的一些爭議。在這裡, 我們將討論支持和反對這種L1CAM免疫捕獲用於分離腦源性EVs的證據。
L1CAM和胞外體(Extracellular vesicles, EVs)的歷史
在EVs領域的研究初期, 對於EVs的描述並沒有達成普遍的共識。雖然”EVs”一詞的採用現在很普遍, 但”外泌體(exosome)”的使用—其專門定義為源自多泡體的EVs—仍然經常被錯誤地用來泛指文獻中存在的任何小型EVs。在本文中,我們將使用術語EVs來表示所有類型的胞外體以消除混淆, 而不考慮原始研究中使用的術語, 這已經在我們公司舉辦的講座中多次出現。
L1CAM於2002年由Peter Altevogt的小組首次描述其與EVs相關聯[6]。該小組後來發現L1CAM被包括ADAM10在內的蛋白酶從細胞質膜上切割下來, 也會從 EVs的表面切割下來[6,7]。這就提出了一個問題 -- 即從EVs中脫落的L1CAM是否會抑制L1CAM-EVs的免疫捕獲。為了解決這個問題, 蛋白酶抑制劑通常會包含在免疫捕獲的工作流程中。然而在取樣之前, 內源性蛋白酶很可能已經從體內的EVs中剝離了至少一部分L1CAM。
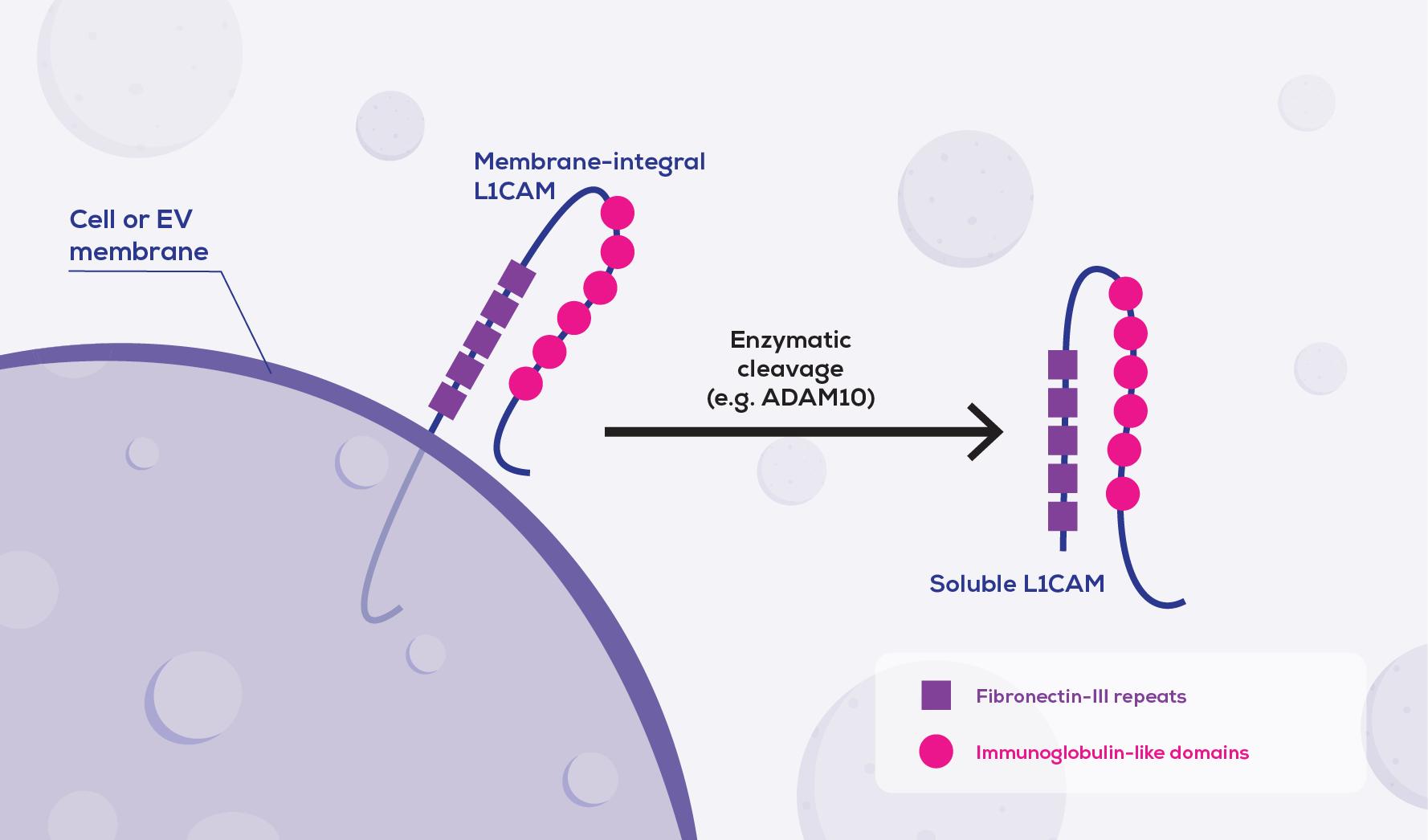 Altevogt的工作很快就被其他的研究人員跟進, 他們開始嘗試從循環中分離神經元細胞-EVs。該領域發表文獻最多的研究人員之一是 Dimitrios Kapogiannis。2015年, Kapogiannis是某篇論文的共同第一作者, 在該論文中, 使用基於沉澱法分離的EVs先於蒸餾水中重懸, 然後使用生物素化抗L1CAM抗體進行免疫捕獲, 然後使用鏈黴親和素-瓊脂糖磁珠做”富集”的動作[8]。
然而這些研究缺乏免疫捕獲的同種型對照組, 雖然在 L1CAM 免疫捕獲的製劑中發現了一些神經元蛋白, 但沒有確認存在有EVs, 因此無法確定神經元-EVs是否被免疫捕獲。
自那以後,Kapogiannis 和他的團隊在大量論文中使用了這種方法, 但直到 2019 年才首次真正證實他們的L1CAM免疫捕獲中存在有EVs, 有多項證據結論(包括以電子顯微鏡觀察球形顆粒、Western印跡研究顯示沒有非EVs的標記和EV標記的存在和奈米粒徑/濃度數據的評估)表明, 其可以使用這種方法分離一些EVs, 但這些EVs的起源還是一個懸而未決的問題[9]。
雖然這些EVs中的一部分可能是神經元起源的, 但來自其他表達L1CAM的細胞-EVs很可能是由其他雜蛋白所共分離出來的; 因此如要假設使用L1CAM免疫捕獲分離的EVs的內容將會反應出相應的神經元EVs的內容, 這種結論可能是有偏差的。
由於使用瓊脂糖磁珠會存在非特異性結合的問題, George Tofaris實驗室將磁珠塗在聚羧基甜菜堿甲基丙烯酸酯中以減少其非特異性結合[10]。然後他們將這些磁珠與抗L1CAM抗體進行偶聯, 並與已通過高達10,000 xg的差速離心去除較大顆粒的血清樣品做孵育。接著做掃描電子顯微鏡顯示, 抗L1CAM包被的磁珠在其表面上顯示出粒徑與EVs一致的球形結構, 而對照抗體包被的磁珠則沒有[10,11]。從這些磁珠中洗脫的顆粒也顯示出EVs樣子的杯形形態特徵。這些顆粒的EVs biomarker為陽性, 並以蛋白組分析具有富含EVs的基因屬性分類[11]。該方法還捕獲了切割的L1CAM, 如在蛋白質印跡上出現較低分子量的條帶所示。Tofaris的實驗室估計, 血清中約有15%的EVs為L1CAM陽性, 而約有75%為CD9陽性。這強調了與 L1CAM 相關的EVs來自不同來源的可能性。
Torafis實驗室的工作結果增加了使用L1CAM免疫捕獲技術分離EVs的可信度。他們還表明, 在L1CAM免疫捕獲分離物中存在α-突觸核蛋白, 這是一種與帕金森病患者大腦中聚集相關的蛋白質[10,11]。雖然這並不一定就意味著這些EVs起源於神經元, 但其仍然可能為能有效的預測測試的工具。
L1CAM相關神經元EVs的爭議
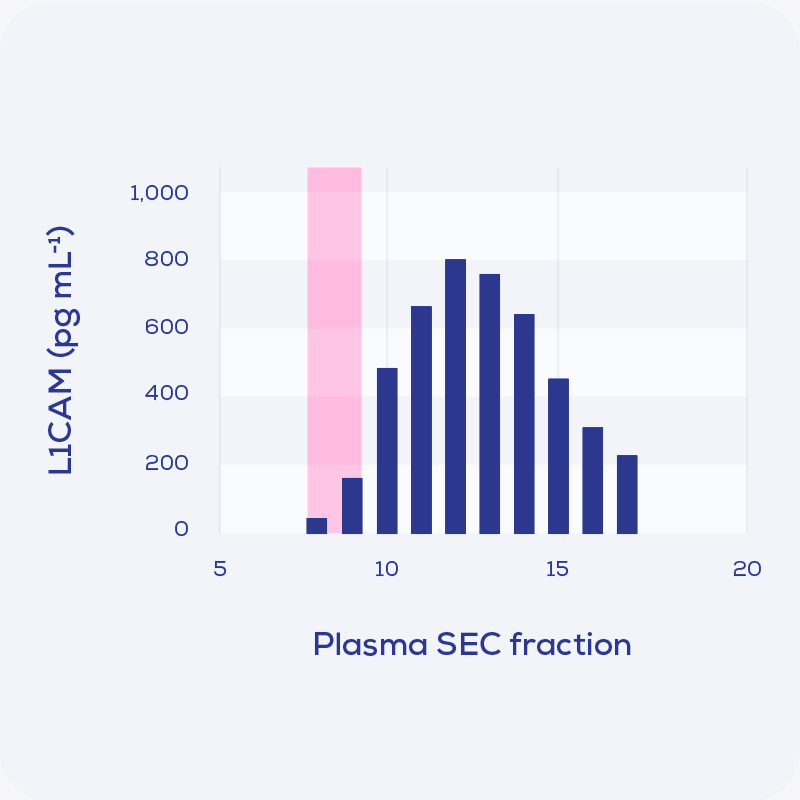
在David Walt實驗室發表的2021 Nature Methods論文中, 他們使用了尺寸排阻色譜(SEC)的column在免疫捕獲或蛋白質分析之前進行分離純化EVs[12]。在分析plasma和CSF衍生的EVs時, L1CAM不會與EVs同時洗脫出現, 而是在含有可溶性蛋白質的餾份中稍晚的洗脫出來。雖然來自CSF和plasma的L1CAM在含有EVs的餾份中有少量存在, 但這僅占總L1CAM的很少一部分。這表明雖然plasma和CSF中的一小部分EVs可能含有 L1CAM, 但L1CAM的可溶形式卻更為豐富。有趣的是, 雖然之前的研究(例如 Tofaris)已經確定了與 L1CAM 免疫捕獲的EVs相關的α-突觸核蛋白, 但Walt的小組發現與抗L1CAM抗體結合的重組 α-突觸核蛋白是IgG對照的三倍[12]。這些發現表明α-突觸核蛋白可能與至少一種抗L1CAM抗體存在非特異性結合, 因此在評估α-突觸核蛋白和L1CAM免疫捕獲的EVs相關的研究結果時必須非常謹慎小心。
Altevogt的工作很快就被其他的研究人員跟進, 他們開始嘗試從循環中分離神經元細胞-EVs。該領域發表文獻最多的研究人員之一是 Dimitrios Kapogiannis。2015年, Kapogiannis是某篇論文的共同第一作者, 在該論文中, 使用基於沉澱法分離的EVs先於蒸餾水中重懸, 然後使用生物素化抗L1CAM抗體進行免疫捕獲, 然後使用鏈黴親和素-瓊脂糖磁珠做”富集”的動作[8]。
然而這些研究缺乏免疫捕獲的同種型對照組, 雖然在 L1CAM 免疫捕獲的製劑中發現了一些神經元蛋白, 但沒有確認存在有EVs, 因此無法確定神經元-EVs是否被免疫捕獲。
自那以後,Kapogiannis 和他的團隊在大量論文中使用了這種方法, 但直到 2019 年才首次真正證實他們的L1CAM免疫捕獲中存在有EVs, 有多項證據結論(包括以電子顯微鏡觀察球形顆粒、Western印跡研究顯示沒有非EVs的標記和EV標記的存在和奈米粒徑/濃度數據的評估)表明, 其可以使用這種方法分離一些EVs, 但這些EVs的起源還是一個懸而未決的問題[9]。
雖然這些EVs中的一部分可能是神經元起源的, 但來自其他表達L1CAM的細胞-EVs很可能是由其他雜蛋白所共分離出來的; 因此如要假設使用L1CAM免疫捕獲分離的EVs的內容將會反應出相應的神經元EVs的內容, 這種結論可能是有偏差的。
由於使用瓊脂糖磁珠會存在非特異性結合的問題, George Tofaris實驗室將磁珠塗在聚羧基甜菜堿甲基丙烯酸酯中以減少其非特異性結合[10]。然後他們將這些磁珠與抗L1CAM抗體進行偶聯, 並與已通過高達10,000 xg的差速離心去除較大顆粒的血清樣品做孵育。接著做掃描電子顯微鏡顯示, 抗L1CAM包被的磁珠在其表面上顯示出粒徑與EVs一致的球形結構, 而對照抗體包被的磁珠則沒有[10,11]。從這些磁珠中洗脫的顆粒也顯示出EVs樣子的杯形形態特徵。這些顆粒的EVs biomarker為陽性, 並以蛋白組分析具有富含EVs的基因屬性分類[11]。該方法還捕獲了切割的L1CAM, 如在蛋白質印跡上出現較低分子量的條帶所示。Tofaris的實驗室估計, 血清中約有15%的EVs為L1CAM陽性, 而約有75%為CD9陽性。這強調了與 L1CAM 相關的EVs來自不同來源的可能性。
Torafis實驗室的工作結果增加了使用L1CAM免疫捕獲技術分離EVs的可信度。他們還表明, 在L1CAM免疫捕獲分離物中存在α-突觸核蛋白, 這是一種與帕金森病患者大腦中聚集相關的蛋白質[10,11]。雖然這並不一定就意味著這些EVs起源於神經元, 但其仍然可能為能有效的預測測試的工具。
L1CAM相關神經元EVs的爭議
在David Walt實驗室發表的2021 Nature Methods論文中, 他們使用了尺寸排阻色譜(SEC)的column在免疫捕獲或蛋白質分析之前進行分離純化EVs[12]。在分析plasma和CSF衍生的EVs時, L1CAM不會與EVs同時洗脫出現, 而是在含有可溶性蛋白質的餾份中稍晚的洗脫出來。雖然來自CSF和plasma的L1CAM在含有EVs的餾份中有少量存在, 但這僅占總L1CAM的很少一部分。這表明雖然plasma和CSF中的一小部分EVs可能含有 L1CAM, 但L1CAM的可溶形式卻更為豐富。有趣的是, 雖然之前的研究(例如 Tofaris)已經確定了與 L1CAM 免疫捕獲的EVs相關的α-突觸核蛋白, 但Walt的小組發現與抗L1CAM抗體結合的重組 α-突觸核蛋白是IgG對照的三倍[12]。這些發現表明α-突觸核蛋白可能與至少一種抗L1CAM抗體存在非特異性結合, 因此在評估α-突觸核蛋白和L1CAM免疫捕獲的EVs相關的研究結果時必須非常謹慎小心。
 此外Gomes和Witwer於2022年進行的一項系統評價時發現了一個有趣的觀點[13]。雖然他們分析的大多數研究都使用了針對L1CAM胞外域的抗體, 但有兩項報告使用針對細胞質部分的抗體對EVs進行了免疫捕獲。這提出了一個尚未在文獻中討論的重要問題: 可溶性 L1CAM 能否與EVs進行外部結合?
L1CAM 的細胞外部分包含Ig結構域和纖連蛋白III樣重複序列, 這使得L1CAM具有”粘性”, 意味著它可能與多種Ig樣和纖連蛋白III樣結構域的蛋白質相結合。例如已知L1CAM與FGFR1[14], NCAM[15]和Neuropilin-1[16]相結合, 所有這些都已在 EVs[17]中鑒定出。L1CAM可能只是修飾EVs, 因此在某些情況下可以在免疫捕獲期間充當抗L1CAM抗體和EVs之間的橋樑。可溶性 L1CAM 可以與表面具有 L1CAM 鍵結蛋白的任何EVs結合。
Witwer實驗室在ISEV2021的衛星會議上提供的題為”L1CAM的爭議”的資料中,使用直接從腦組織(bdEV)中分離出來的EVs來研究L1CAM和神經元EVs之間的聯繫。他們發現L1CAM在bdEV上的含量低於其他神經元標誌物, 因此, 抗 L1CAM抗體分離的bdEV不到 1%, 遠低於針對另一種神經元粘附分子NCAM的抗體; 最近的一項研究支持了這一點, 其使用單一EVs粒子分析顯示NCAM做為plasma中神經元EVs標記物的效用[18]。
Witwer的小組還提供資料顯示bdEV製劑中的L1CAM不包含可測量的跨膜結構域, 支持其神經元EVs上的L1CAM 有至少部分是以可溶形式的理論。
最近在ISEV2022上也發表了關於該主題的幾篇摘要[19]。Kapogiannis實驗室使用SEC(qEV10/70 nm 系列)將EVs從蛋白質中分離出來, 然後使用免疫電子顯微鏡檢測L1CAM的雙陽性顆粒, 以及EVs標記物Alix或建議的神經元標記 VAMP2。這表明L1CAM可能與EVs相關但不排除L1CAM是與EVs上的膜整合蛋白結合的外部蛋白質。然而VAMP2可在腦外表達, 因此無法在沒有其他標記來確認來源的情況下將其用作腦特異性標記。Kapogiannis實驗室還提供了自製的測定方法的資料, 該測定使用抗 L1CAM(克隆 5G3)作為捕獲抗體和針對EVs四跨膜蛋白 CD9、CD81 和 CD63 的抗體作為檢測抗體。這與使用抗 L1CAM(克隆 5G3)抗體捕獲和抗L1CAM(克隆 UJ127)抗體檢測的Walt組使用的測定法進行了比較。
正如所料, Kapogiannis 實驗室自製檢測僅在EVs的相關部分檢測到 L1CAM, 因為它們的檢測抗體只能檢測與EVs相關的L1CAM。而 Walt 小組使用的分析顯示, 當他們分析測量所有的L1CAM時, 可在雜蛋白餾份中發現信號。
現有結論
目前尚不足以確定L1CAM是否以跨膜形式與EVs相關(或作為可溶性蛋白結合到EVs外部)或L1CAM相關的EVs是否起源於神經元。因此在該領域達成共識之前還需要進行更多的研究。
無論此類研究的結果如何, L1CAM和神經元EVs的故事都給了我們警示, 其強調的是需要對EVs分離純化方法進行嚴格的測試, 尤其是包括免疫捕獲技術在內的技術。必須在免疫捕獲之前就執行一個乾淨、可重複的EVs分離純化技術(例如SEC column)以最大限度地減少所關注的可溶性蛋白質的污染。此外對特定的EVs亞群關注的有效免疫捕獲可能需要不止一個免疫捕獲步驟, 每個步驟都要選擇不同的亞群特異性標記。這將通過組合標記以最大限度的減少非特異性表達的問題, 並可能可產生更小、更純、更特異的EVs群體。
”純度”在診斷的發現階段尤為重要, 因為必須確保生物標誌物是特異性的, 而不是潛在的多種病理的次要後果。從更具體的EVs亞群開始有助於確保生物標誌物是特定於疾病的, 而不是多種病理之現象的次要後果。對於諸如尋找生物標誌物的發現研究或旨在瞭解生物學或病理學的研究, 可使用多個捕獲抗體的步驟以實現更具特異性的方法。
參考文獻
1. Lutz, D., Wolters-Eisfeld, G., Schachner, M. & Kleene, R. Cathepsin E generates a sumoylated intracellular fragment of the cell adhesion molecule L1 to promote neuronal and Schwann cell migration as well as myelination. Journal of Neurochemistry 128, 713-724 (2014). https://doi.org:10.1111/jnc.12473
2. Platek, R., Grycz, K., Wieckowska, A., Czarkowska-Bauch, J. & Skup, M. L1 Cell Adhesion Molecule Overexpression Down Regulates Phosphacan and Up Regulates Structural Plasticity-Related Genes Rostral and Caudal to the Complete Spinal Cord Transection. Journal of Neurotrauma 37, 534-554 (2020). https://doi.org:10.1089/neu.2018.6103
3. Karlsson, M. et al. A single-cell type transcriptomics map of human tissues. Science Advances 7 (2021). https://doi.org:10.1126/sciadv.abh2169
4. Tischler, V. et al. L1CAM protein expression is associated with poor prognosis in non-small cell lung cancer. Molecular Cancer 10 (2011). https://doi.org:10.1186/1476-4598-10-127
5. Fogel, M. et al. L1 expression as a predictor of progression and survival in patients with uterine and ovarian carcinomas. Lancet 362, 869-875 (2003). https://doi.org:10.1016/s0140-6736(03)14342-5
6. Gutwein, P. et al. ADAM10-mediated cleavage of L1 adhesion molecule at the cell surface and in released membrane vesicles. Faseb Journal 16, 292-+ (2002). https://doi.org:10.1096/fj.02-0430fje
7. Gutwein, P. et al. Cleavage of L1 in exosomes and apoptotic membrane vesicles released from ovarian carcinoma cells. Clinical Cancer Research 11, 2492-2501 (2005). https://doi.org:10.1158/1078-0432.ccr-04-1688
8. Fiandaca, M. S. et al. Identification of preclinical Alzheimer's disease by a profile of pathogenic proteins in neurally derived blood exosomes: A case-control study. Alzheimers & Dementia 11, 600-607 (2015). https://doi.org:10.1016/j.jalz.2014.06.008
9. Kapogiannis, D. et al. Association of Extracellular Vesicle Biomarkers With Alzheimer Disease in the Baltimore Longitudinal Study of Aging. Jama Neurology 76, 1340-1351 (2019). https://doi.org:10.1001/jamaneurol.2019.2462
10. Jiang, C. et al. Serum neuronal exosomes predict and differentiate Parkinson's disease from atypical parkinsonism. Journal of Neurology Neurosurgery and Psychiatry 91, 720-729 (2020). https://doi.org:10.1136/jnnp-2019-322588
11. Fu, Y., Jiang, C., Tofaris, G. K. & Davis, J. J. Facile Impedimetric Analysis of Neuronal Exosome Markers in Parkinson's Disease Diagnostics. Analytical Chemistry 92, 13647-13651 (2020). https://doi.org:10.1021/acs.analchem.0c03092
12. Norman, M. et al. L1CAM is not associated with extracellular vesicles in human cerebrospinal fluid or plasma. Nature Methods 18, 631-+ (2021). https://doi.org:10.1038/s41592-021-01174-8
13. Gomes, D. E. & Witwer, K. W. L1CAM-associated extracellular vesicles: A systematic review of nomenclature, sources, separation, and characterization. J Extracell Biol 1 (2022). https://doi.org:10.1002/jex2.35
14. Kulahin, N. et al. Fibronectin type III (FN3) modules of the neuronal cell adhesion molecule L1 interact directly with the fibroblast growth factor (FGF) receptor. Molecular and Cellular Neuroscience 37, 528-536 (2008). https://doi.org:10.1016/j.mcn.2007.12.001
15. Friedlander, D. R. et al. The neuronal chondroitin sulfate proteoglycan neurocan binds to the neural cell adhesion molecules Ng-CAM/L1/NILE and N-CAM, and inhibits neuronal adhesion and neurite outgrowth. J Cell Biol 125, 669-680 (1994). https://doi.org:10.1083/jcb.125.3.669
16. Stoeck, A. et al. L1 on ovarian carcinoma cells is a binding partner for Neuropilin-1 on mesothelial cells. Cancer Letters 239, 212-226 (2006). https://doi.org:10.1016/j.canlet.2005.08.005
17. Kalra, H. et al. Vesiclepedia: A Compendium for Extracellular Vesicles with Continuous Community Annotation. Plos Biology 10 (2012). https://doi.org:10.1371/journal.pbio.1001450
18. Moussa, H. Y. A. et al. Single Extracellular Vesicle Analysis Using Flow Cytometry for Neurological Disorder Biomarkers. Frontiers in Integrative Neuroscience 16 (2022). https://doi.org:10.3389/fnint.2022.879832
19. ISEV2022 Abstract Book Abstracts. Journal of Extracellular Vesicles 11 (2022). https://doi.org:10.1002/jev2.1222
此外Gomes和Witwer於2022年進行的一項系統評價時發現了一個有趣的觀點[13]。雖然他們分析的大多數研究都使用了針對L1CAM胞外域的抗體, 但有兩項報告使用針對細胞質部分的抗體對EVs進行了免疫捕獲。這提出了一個尚未在文獻中討論的重要問題: 可溶性 L1CAM 能否與EVs進行外部結合?
L1CAM 的細胞外部分包含Ig結構域和纖連蛋白III樣重複序列, 這使得L1CAM具有”粘性”, 意味著它可能與多種Ig樣和纖連蛋白III樣結構域的蛋白質相結合。例如已知L1CAM與FGFR1[14], NCAM[15]和Neuropilin-1[16]相結合, 所有這些都已在 EVs[17]中鑒定出。L1CAM可能只是修飾EVs, 因此在某些情況下可以在免疫捕獲期間充當抗L1CAM抗體和EVs之間的橋樑。可溶性 L1CAM 可以與表面具有 L1CAM 鍵結蛋白的任何EVs結合。
Witwer實驗室在ISEV2021的衛星會議上提供的題為”L1CAM的爭議”的資料中,使用直接從腦組織(bdEV)中分離出來的EVs來研究L1CAM和神經元EVs之間的聯繫。他們發現L1CAM在bdEV上的含量低於其他神經元標誌物, 因此, 抗 L1CAM抗體分離的bdEV不到 1%, 遠低於針對另一種神經元粘附分子NCAM的抗體; 最近的一項研究支持了這一點, 其使用單一EVs粒子分析顯示NCAM做為plasma中神經元EVs標記物的效用[18]。
Witwer的小組還提供資料顯示bdEV製劑中的L1CAM不包含可測量的跨膜結構域, 支持其神經元EVs上的L1CAM 有至少部分是以可溶形式的理論。
最近在ISEV2022上也發表了關於該主題的幾篇摘要[19]。Kapogiannis實驗室使用SEC(qEV10/70 nm 系列)將EVs從蛋白質中分離出來, 然後使用免疫電子顯微鏡檢測L1CAM的雙陽性顆粒, 以及EVs標記物Alix或建議的神經元標記 VAMP2。這表明L1CAM可能與EVs相關但不排除L1CAM是與EVs上的膜整合蛋白結合的外部蛋白質。然而VAMP2可在腦外表達, 因此無法在沒有其他標記來確認來源的情況下將其用作腦特異性標記。Kapogiannis實驗室還提供了自製的測定方法的資料, 該測定使用抗 L1CAM(克隆 5G3)作為捕獲抗體和針對EVs四跨膜蛋白 CD9、CD81 和 CD63 的抗體作為檢測抗體。這與使用抗 L1CAM(克隆 5G3)抗體捕獲和抗L1CAM(克隆 UJ127)抗體檢測的Walt組使用的測定法進行了比較。
正如所料, Kapogiannis 實驗室自製檢測僅在EVs的相關部分檢測到 L1CAM, 因為它們的檢測抗體只能檢測與EVs相關的L1CAM。而 Walt 小組使用的分析顯示, 當他們分析測量所有的L1CAM時, 可在雜蛋白餾份中發現信號。
現有結論
目前尚不足以確定L1CAM是否以跨膜形式與EVs相關(或作為可溶性蛋白結合到EVs外部)或L1CAM相關的EVs是否起源於神經元。因此在該領域達成共識之前還需要進行更多的研究。
無論此類研究的結果如何, L1CAM和神經元EVs的故事都給了我們警示, 其強調的是需要對EVs分離純化方法進行嚴格的測試, 尤其是包括免疫捕獲技術在內的技術。必須在免疫捕獲之前就執行一個乾淨、可重複的EVs分離純化技術(例如SEC column)以最大限度地減少所關注的可溶性蛋白質的污染。此外對特定的EVs亞群關注的有效免疫捕獲可能需要不止一個免疫捕獲步驟, 每個步驟都要選擇不同的亞群特異性標記。這將通過組合標記以最大限度的減少非特異性表達的問題, 並可能可產生更小、更純、更特異的EVs群體。
”純度”在診斷的發現階段尤為重要, 因為必須確保生物標誌物是特異性的, 而不是潛在的多種病理的次要後果。從更具體的EVs亞群開始有助於確保生物標誌物是特定於疾病的, 而不是多種病理之現象的次要後果。對於諸如尋找生物標誌物的發現研究或旨在瞭解生物學或病理學的研究, 可使用多個捕獲抗體的步驟以實現更具特異性的方法。
參考文獻
1. Lutz, D., Wolters-Eisfeld, G., Schachner, M. & Kleene, R. Cathepsin E generates a sumoylated intracellular fragment of the cell adhesion molecule L1 to promote neuronal and Schwann cell migration as well as myelination. Journal of Neurochemistry 128, 713-724 (2014). https://doi.org:10.1111/jnc.12473
2. Platek, R., Grycz, K., Wieckowska, A., Czarkowska-Bauch, J. & Skup, M. L1 Cell Adhesion Molecule Overexpression Down Regulates Phosphacan and Up Regulates Structural Plasticity-Related Genes Rostral and Caudal to the Complete Spinal Cord Transection. Journal of Neurotrauma 37, 534-554 (2020). https://doi.org:10.1089/neu.2018.6103
3. Karlsson, M. et al. A single-cell type transcriptomics map of human tissues. Science Advances 7 (2021). https://doi.org:10.1126/sciadv.abh2169
4. Tischler, V. et al. L1CAM protein expression is associated with poor prognosis in non-small cell lung cancer. Molecular Cancer 10 (2011). https://doi.org:10.1186/1476-4598-10-127
5. Fogel, M. et al. L1 expression as a predictor of progression and survival in patients with uterine and ovarian carcinomas. Lancet 362, 869-875 (2003). https://doi.org:10.1016/s0140-6736(03)14342-5
6. Gutwein, P. et al. ADAM10-mediated cleavage of L1 adhesion molecule at the cell surface and in released membrane vesicles. Faseb Journal 16, 292-+ (2002). https://doi.org:10.1096/fj.02-0430fje
7. Gutwein, P. et al. Cleavage of L1 in exosomes and apoptotic membrane vesicles released from ovarian carcinoma cells. Clinical Cancer Research 11, 2492-2501 (2005). https://doi.org:10.1158/1078-0432.ccr-04-1688
8. Fiandaca, M. S. et al. Identification of preclinical Alzheimer's disease by a profile of pathogenic proteins in neurally derived blood exosomes: A case-control study. Alzheimers & Dementia 11, 600-607 (2015). https://doi.org:10.1016/j.jalz.2014.06.008
9. Kapogiannis, D. et al. Association of Extracellular Vesicle Biomarkers With Alzheimer Disease in the Baltimore Longitudinal Study of Aging. Jama Neurology 76, 1340-1351 (2019). https://doi.org:10.1001/jamaneurol.2019.2462
10. Jiang, C. et al. Serum neuronal exosomes predict and differentiate Parkinson's disease from atypical parkinsonism. Journal of Neurology Neurosurgery and Psychiatry 91, 720-729 (2020). https://doi.org:10.1136/jnnp-2019-322588
11. Fu, Y., Jiang, C., Tofaris, G. K. & Davis, J. J. Facile Impedimetric Analysis of Neuronal Exosome Markers in Parkinson's Disease Diagnostics. Analytical Chemistry 92, 13647-13651 (2020). https://doi.org:10.1021/acs.analchem.0c03092
12. Norman, M. et al. L1CAM is not associated with extracellular vesicles in human cerebrospinal fluid or plasma. Nature Methods 18, 631-+ (2021). https://doi.org:10.1038/s41592-021-01174-8
13. Gomes, D. E. & Witwer, K. W. L1CAM-associated extracellular vesicles: A systematic review of nomenclature, sources, separation, and characterization. J Extracell Biol 1 (2022). https://doi.org:10.1002/jex2.35
14. Kulahin, N. et al. Fibronectin type III (FN3) modules of the neuronal cell adhesion molecule L1 interact directly with the fibroblast growth factor (FGF) receptor. Molecular and Cellular Neuroscience 37, 528-536 (2008). https://doi.org:10.1016/j.mcn.2007.12.001
15. Friedlander, D. R. et al. The neuronal chondroitin sulfate proteoglycan neurocan binds to the neural cell adhesion molecules Ng-CAM/L1/NILE and N-CAM, and inhibits neuronal adhesion and neurite outgrowth. J Cell Biol 125, 669-680 (1994). https://doi.org:10.1083/jcb.125.3.669
16. Stoeck, A. et al. L1 on ovarian carcinoma cells is a binding partner for Neuropilin-1 on mesothelial cells. Cancer Letters 239, 212-226 (2006). https://doi.org:10.1016/j.canlet.2005.08.005
17. Kalra, H. et al. Vesiclepedia: A Compendium for Extracellular Vesicles with Continuous Community Annotation. Plos Biology 10 (2012). https://doi.org:10.1371/journal.pbio.1001450
18. Moussa, H. Y. A. et al. Single Extracellular Vesicle Analysis Using Flow Cytometry for Neurological Disorder Biomarkers. Frontiers in Integrative Neuroscience 16 (2022). https://doi.org:10.3389/fnint.2022.879832
19. ISEV2022 Abstract Book Abstracts. Journal of Extracellular Vesicles 11 (2022). https://doi.org:10.1002/jev2.1222
