最新消息
2022-06-30
[文獻分享:JEV選擇TRPS和qEV研究胞外體(外泌體)的儲存條件]
簡介: 如何儲存胞外體(Extracellular vesicles, EVs)? 儘管現代醫學和生物技術領域對EVs的興趣和研究越來越多, 但在EVs的分離、表徵測量和存儲方面仍面臨挑戰, 而且缺乏標準化的指南。不斷增加的證據表明, 不同的儲存條件對EVs的濃度, 物理性質和生物功能有著極大的影響, 包括新鮮樣本中分離的EVs和從生物庫保存的樣本中提取的EVs。 2013年, 國際細胞外囊泡學會(ISEV)建議將樣本保存在−80°C並進一步規定將EVs存儲在矽基容器的磷酸鹽緩衝溶液(PBS)中。然而在2018年更新的ISEV指南中已不再提供生物樣本或EVs存儲的標準說法, 這些指南意識到儲存條件對EVs及其基質的影響, 建議指出應明確描述準確的存儲策略並用以促進進一步的研究, 以更好地闡明存儲和恢復的效果。然而不少儲存條件的研究都有著不同的結論, 目前仍缺乏同時比較不同儲存條件的研究。 這篇今年發表在Journal of Extracellular vesicle (ISEV)雜誌上的文章題為The impact of storage on extracellular vesicles: A systematic study彌補了這一缺失。 討論: 為了比較從新鮮樣本中分離的EVs和不同儲存條件下的EVs, 作者計畫了三組實驗: 1. 比較從無血小板血漿(pPFP)中經qEV column分離純化的新鮮EVs、在低溫容器中儲存的經qEV column分離純化的pPFP-EV(-80°C下8種不同條件)以及從儲存的pPFP(-80°C下的8種不同條件)中使用qEV column分離的EVs。 2. 比較新鮮的pPFP-EV與冷凍-解凍週期較慢的pPFP-EV和冷凍-解凍週期較短的pPFP-EV。 3. 使用從小鼠小膠質細胞系中分離的EVs分析其在儲存和凍融週期中可能發生的融合現象。作者對細胞進行基因修飾, 使其以膜蛋白的形式表達綠色螢光蛋白GFP或mCherry蛋白並用流式細胞技術檢測“雙陽性”信號為可能的融合事件, 即EV膜斷裂和脂質重新膠束化(儘管不能排除EV粒子發生團聚)。該文獻的主要結果如下: 首先作者展示了隨著時間的增加(下圖, 原文圖2利用TRPS技術奈米粒徑分析), 在−80°C存儲條件中會降低了凍存的EVs產量(a)和從凍存血漿樣本中恢復的EVs數量(e)。同時,新鮮樣本提取的EVs(b)和從凍存血漿樣本中提取的EVs(f)中, 污染物蛋白的含量也都隨著時間逐漸上升。凍存EVs會導致中位數粒徑(c)和粒徑變異性(d)顯著增加; 相反, 從凍存血漿樣本中提取的EVs的中位數粒徑(g)和粒徑變異性(h)未顯著增加。
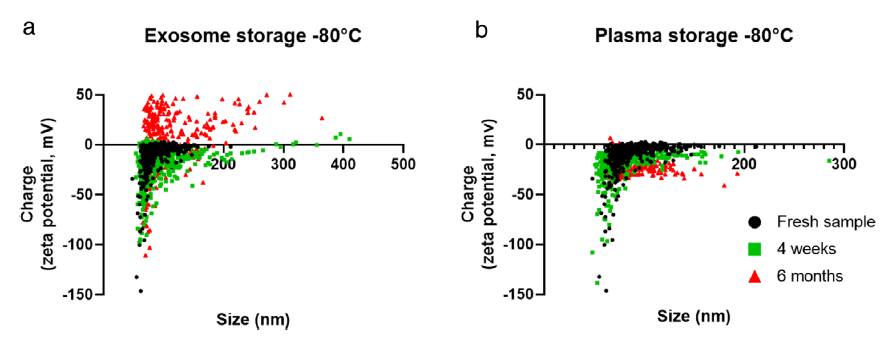
因為TRPS技術可以觀測到單顆粒層面的顆粒粒徑和Zeta電位, 這使得在單顆粒水準上評估Zeta電位的變化是可行的, 並能提供了不受粒徑分佈影響的Zeta電位資料, 可以表示為粒徑與電荷的關係圖。原文圖3中, 作者發現凍存新鮮提取的EVs導致Zeta電位分佈隨著凍存時間改變, 趨於正值(a中紅色)。然而從凍存血漿樣本中提取的EVs並未觀測到上述Zeta電位分佈改變趨勢(b)。
隨著時間增加, 所有的儲存策略(海藻糖溶液、DMSO溶液、甘油溶液、蛋白酶抑制劑、疊氮化鈉, 溶解於海藻糖溶液後凍乾)都無法避免降低的EVs產量(原文圖4)+增加污染物蛋白的濃度+中位數粒徑和改變的Zeta電位分佈。濃度、粒徑和Zeta電位均由TRPS技術測量得出(如下圖, 原文圖4, S2-S4)。 原文圖5中, 作者發現第一次速凍會顯著降低EVs的產率(b), 之後的第二與第三次速凍後與第一次無明顯差異; 並且緩慢冷凍和速凍之間並沒有差異。 原文圖6中, 凍融過程導致會EVs數量下降, 但帶有GFP和mCherry雙陽性(融合)的EVs數量上升會(a)。然後作者分別分析小型EVs (sEV, 20-200nm)和大型EVs(lEV, 200-800nm)並發現了不同的結果。sEV濃度在第一與第二次凍融時會急劇下降, 帶有GFP-mCherry雙陽性的sEVs會略微增多(b); lEV濃度在凍融過程中會有變動, 但帶有GFP-mCherry雙陽性的lEVs數量會增加(c)。 原文圖7中, 在第二次凍融後, 使用TRPS技術觀測到EVs數量有顯著下降(a), sEV也有類似的趨勢(b)。對於IEVs, 儘管中位數濃度在第一次凍融後會下降但其並不具有統計學意義(c)。至於IEV占總EVs的比例, 在第二次凍融後反而比第一次凍融和新提取的樣本有顯著增加了(d)。 總結: 作者最後總結, 要同時分析不同來源或患者的樣本或者對以前儲存在生物樣本庫中的樣本進行研究需要有價值的存儲策略, 而這在目前是急需且非常緊迫的。 這也強調了在胞外體研究中, 需要進一步研究以改進儲存技術和減少分析前的可變性。但是, 該文獻認為應當建議使用新鮮的樣本進行實驗。當樣本無法避免需要儲存時, 根據該文獻的觀察, 可以建議在較短的保存時間內於-80°C儲存生物基質 (biological matrix, 例如血漿)而不是去儲存已經純化好的EVs。最後該文獻強調, 在比較不同EVs研究和資料時, 需要考慮不同的存儲條件(如果有)。 参考文献 Gelibter, S., Marostica, G., Mandelli, A., Siciliani, S., Podini, P., Finardi, A., & Furlan, R. (2022). The impact of storage on extracellular vesicles: A systematic study. Journal of extracellular vesicles, 11(2), e12162.

