最新MISEV外泌體國際標準指南
台灣諾曼達科技為TSEV(台灣胞外體學會)指定合作夥伴, 提供國際權威認證的完整平台和最專業的相關知識, 在外泌體(Exosome) / 細胞外囊泡(Extracellular vesicles)相關之研究、製造、品管等方面皆已有多篇著名期刊引用, 目前已在國內各單位舉辦超過30場外泌體研究與製程分析講座, 如有相關需求歡迎聯絡洽詢。
做為在外泌體領域的指定合作單位, 我們替您解析了MISEV2018的內容如下:
 |
-
-
命名法
細胞外囊泡(Extracellular Vesicles, EVs)指的是經細胞釋放而具有脂質雙分子層的顆粒, 不能複製即不包含具有功能的核心
而外泌體(Exosomes)和微囊泡(Microvesicles)都是EVs的亞分類, 目前並沒有單一技術可完全證明所屬是哪一種, 這代表我們需要建立一個完整的驗證模式, 比如依據EVs的物理特性、生化成分、處理條件、細胞起源或是依自有的發現法命名, 如果無法依照 MISEV2018 的方法命名, 我們的建議是用微粒(Extracellualr Particles, EP)取代
可是外泌體(Exosomes)的說法實在很吸引人, 相較下EVs的稱呼似乎沒這麼好用, 我們可以建議您針對計劃書、專業性期刊或是囊泡相關的期刊的說法, 歡迎進一步聯絡我們-
樣品的前處理
包含細胞條件培養液、生物體液和組織等類型
如何去除細胞條件培養液中FBS的EVs -
1. 配置好的培養液(或 20% FBS 培養液), 以 100,000g/18 hrs 離心
2. 配置好的培養液(或 20% FBS 培養液), 以 200,000g/1 hr 離心
3. 使用切向流過濾或是超濾法 (100Kd)
以上的建議還是有補充的注意事項而不一定都可接受, 歡迎進一步聯絡我們-
樣品的儲存
目前已知的保存條件都還可接受並沒有通用的共識形成, 雖然不會影響顆粒濃度但會有粒徑分佈的變化(聚集), 在功能研究的影響不大
-
分離方法的選擇和純度評估
依 MISEV2018 的說法, 提取的方法可分為:
1. 高回收, 低純度 : 主要是目前市面上各種以 PEG 為主的沉澱試劑盒 (Kit)、低分子量截流的超濾、UC 超速離心法等
2. 適中回收, 適中純度 : 包含 SEC 尺寸排阻色譜法、高分子量截流的超濾、差速離心法、切向流過濾、親合層析法
3. 低回收, 高純度 : 結合以上的兩種方式, 例如 UC + SEC, 密度梯度離心或免疫親和捕獲
4. 高回收, 高純度 : 目前還沒有已被承認的方式
那麼要如何選擇合適的提取方法呢, 主要還是依照您的實驗目標和樣品種類來考量, 歡迎進一步聯絡我們-
細胞外囊泡標記物的表徵策略
依 MISEV2018 的說法, 要有兩個陽性蛋白和一個陰性蛋白標記物, 我們的建議是先做跨膜蛋白 Tetraspanins(主要是 CD63, CD8, CD81, CD82)再做膜內標記(主要是 Allx, Tsg101)
在 MISEV2018 Table 3. 內有基於蛋白質含量的 EV 表徵描述 -
1. 與質膜和/或內體有關的跨膜或GPI錨定蛋白
2. EVs 中保留的胞漿蛋白
3. 非 EVs 共分離結構的主要組成部分
4. 除 PM/內體外與其他細胞內區室相關的跨膜、脂質結合和可溶性蛋白
5. EVs 保留的分泌蛋白
第4點和第5點一般為有特異來源時才考慮, 歡迎進一步聯絡我們對於單一囊泡的表徵, 需要使用兩種不同但互補的方法:
1. 例如 AFM 的 SPM 和高分辨率的顯微鏡, 注意要同時提供專一的圖像和廣泛的圖像
2. 利用顆粒分析技術, 例如 TRPS、NTA、FC 等-
EVs 的定量和樣品歸一化
對顆粒濃度(數目): TRPS、NTA、FACS、AFM
對蛋白定量: Bradford / BCA(總蛋白)、ELISA(特定蛋白)
對脂質或RNA總量: 目前尚無已成熟的策略, 仍在確定中
對於歸一化, 目前EVs研究中還沒有公定的內參, 但文獻內有使用外參的說法, 歡迎進一步聯絡我們-
確認特定分子與EVs的拓樸結構
主要是確定所屬分子是在囊泡上或是囊泡內, 抑或是在提取時共沉澱形成的; 注意小心的設置對照組, 歡迎進一步聯絡我們
例如:
1. 未經過任何處理的樣品
2. 只用降解酶處理的樣品
3. 使用降解酶和洗滌劑處理
4. 只用洗滌劑處理-
證明EVs及其內容物與功能的關聯
法1: 以密度梯度提取EVs, 在功能研究中分別測定每個梯度的活性表現
法2: 以SEC管柱提取EVs, 在功能研究中分別測定每個餾份的活性表現
法3: 比較完整的EVs和經洗滌劑處理的活性, 但此法會有些技術的侷限性, 歡迎進一步聯絡我們
法4: 以過量的免疫親和捕獲以去除實驗內的EVs, 檢測此和對照組的功能是否有對應現象
總之, 原理即是去除EVs中的特定分子, 確認功能研究中的EVs是否不再具有對應現象, 也有使用電轉去除法(Electroporation)以上內容即非經許可請勿任意複製轉發分享, 如有任何建議或詢問, 歡迎和我們聯繫
-
台灣諾曼達科技為TSEV(台灣胞外體學會)指定合作夥伴, 提供國際權威認證的完整平台和最專業的相關知識, 在外泌體(Exosome) / 細胞外囊泡(Extracellular vesicles)相關之研究、製造、品管等方面皆已有多篇著名期刊引用, 目前已在國內各單位舉辦超過30場外泌體研究與製程分析講座, 如有相關需求歡迎聯絡洽詢。
做為在外泌體領域的指定合作單位, 我們替您解析了 MISEV2023的內容如下:
 |
摘要
細胞外囊泡(EVs)通過其複雜的貨物, 可以反映其來源細胞的狀態並改變其他細胞的功能和表型。
這些特徵表明了強大的生物標誌物和治療潛力, 並引起了廣泛的興趣, 有關EVs的科學出版物數量逐年穩定增長就是證明。
然而,由於在EV的命名、非囊泡狀細胞外顆粒的分離、表徵和功能研究等方面的挑戰, 要想實現EVs在從基礎生物學到臨床應用等領域的潛力仍存在障礙。
為了應對這一快速發展領域的挑戰和機遇, 國際細胞外囊泡學會(ISEV)更新了其”細胞外囊泡研究的最低資訊”, 該資訊於2014年首次發表, 隨後於2018年分別命名為MISEV2014和MISEV2018。
當前MISEV2023文件的目標是向研究人員提供可用方法的最新快照及其在從多種來源(包括細胞培養物、體液和固體組織)生產、分離和表徵EVs方面的優勢和局限性。
除了介紹EVs研究基本原理的最新技術水準之外, 本文件還涵蓋了目前正在拓展該領域邊界的先進技術和方法。
MISEV2023還包括關於EV釋放和攝取的新章節, 以及對研究EVs於體內方法的簡要討論。
本文彙集了來自ISEV專家工作組和1000多名研究人員的反饋, 傳達了EVs研究的現狀以促進可靠的科學發現, 並能更快地推進該領域。
以上內容即非經許可請勿任意複製轉發分享, 如有任何建議或詢問, 歡迎和我們聯繫
1. ISEV和MISEV的簡介
1.1 細胞外囊泡與ISEV
細胞外囊泡(EVs)在大多數生物系統中扮演著不同而重要的角色, 部分原因在於其組成的複雜性。
EVs是脂質雙層膜界定為奈米至微米大小的顆粒, 似乎可由所有的細胞類型釋放。EVs的分子和結構異質性意味著在基礎生物學以及生物標記物和治療應用的開發方面仍有許多發現要做, 但同樣的複雜性也給EVs研究的每個階段帶來了挑戰。
從定義和分類到分離、表徵、工程與臨床應用, ”細胞外囊泡研究的最低資訊” (MISEV) 旨在幫助EV研究和應用的所有相關從業人員以遵循每個特定問題和指示的最佳實踐。
現在是第三次迭代, MISEV2023做為一份現場共識文件, 旨在前兩次迭代中規定的標準和指南中, 為EV的相關研究提供建議和指導並鼓勵加強研究設計和實驗細節報告, MISEV是由國際細胞外囊泡協會(ISEV)所製作的(https://www.isev.org)。
ISEV成立於2011年其旨在加強全球的EV研究, 是參與細胞外囊泡相關領域科學家和臨床醫生的領先專業協會。
ISEV通過其年會、專題研討會和其他會議(面對面和虛擬)、同行評審期刊、線上學習平台以及與其他協會的夥伴關係, 吸引了世界各地不同的研究人員群體。
因此, ISEV處於獨特的地位並能夠引導關於最佳實踐指南和科學考慮相關專家共識的發展和傳播。
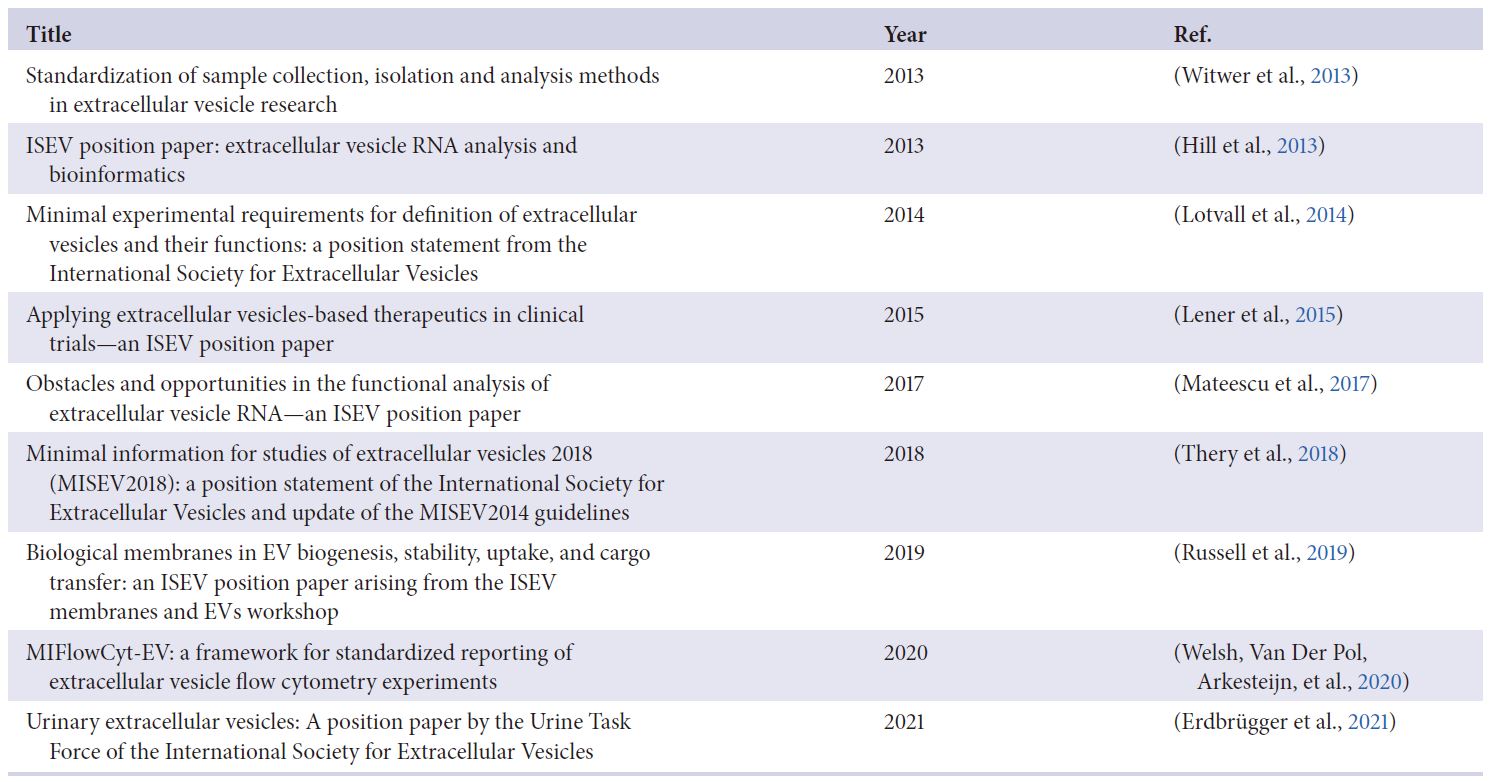
表1. JEV期刊: ISEV立場意見書與陳述
MISEV2014 (Lotvall等人發表, 2014年)是ISEV生產的第一份EV定位報告, 旨在為EV分析提供穩健性。
MISEV2018 (Thery等人發表, 2018)對推進該領域所採用的方法和手段進行了更深入和批判性的評估, 其中許多方法和手段至今仍然有效。MISEV2018還包括建議的實驗方法, 以應對一些剩餘挑戰並提供穩健的EV表徵。
早期MISEV的建議在很大程度上或許完全有效, 且應結合先前的文件來閱讀MISEV2023。
與之前的迭代一樣, MISEV2023為EV研究人員提供了簡明的建議和指導, 對MISEV2018中提出的問題進行了細化, 並為較新的開發領域增加了建議和指導, MISEV2023廣泛涵蓋了EVs的命名、預處理變數、分離與表徵以及EVs的釋放、攝取和功能性的體外和體內分析。
除了之前的MISEV指南之外, ISEV還促進並協調了包括學會內部立場意見書的相關最佳實踐指南和科學考慮的專家共識(Welsh, Van Der Pol, Arkesteijn等人, 2020), 且聚焦在特定主題的專家建議(Erdbrügger 等人發表, 2021; Hill 等人發表, 2013; Lener 等人發表, 2015; Mateescu 等人發表, 2017; Russell 等人發表, 2019; Verweij 等人發表, 2021; Witwer 等人發表, 2013) – 如表1.
最近, ISEV嚴謹性與標準化小組委員會監督特殊利益集團在EVs特定來源和其他EVs相關主題上的任命和活動, ISEV還建議採用其他的報告和圖集工具, 例如”用於即時逆轉錄酶定量聚合酶鏈式反應(qPCR)分析的定量即時PCR實驗出版最低資訊”(MIQE) (Bustin 等人發表, 2009)與EV-TRACK。
總體而言, ISEV的活動和建議都旨在提高EV研究的嚴密性、再現性和透明度。
本MISEV文件的目標是幫助所有在EV研究與應用的所有領域的從業人員在每個單獨的EV來源、類型、研究問題或應用之實施與開發。
1.2 MISEV是什麼? 並不是什麼?
自MISEV2018出現以來, 關於指南的含義以及該如何應用或不該如何應用已經進行了大量討論。根據討論情況, 現將MISEV的現狀和不現狀總結如下。
MISEV是:
- EVs研究簡介。
- 旨在提高EV研究設計、執行和報告期間的嚴密性、再現性和透明度的一組建議。
- 是一種工具, 可幫助審閱者和編輯利用其自身的專家知識, 評估與EV相關的提案、資助申請、摘要和手稿的優缺點。
- 各種有用的EVs技術和平臺的非詳盡示例集。
- 一個支援創新型EVs研究和應用以及從產品開發商到監管機構等各方的嚴格和標準化框架。
- 表明了當前在EVs領域以及一些不確定和增長領域的廣泛共識。
- 與轉化和臨床研究及應用相關, 包括治療性EVs的生產和初步評估。
- 適用於各種EVs研究和應用不僅僅是關於哺乳動物的來源。
儘管MISEV中提供的示例可能特定於哺乳動物EVs, 但基本原則很可能適用於所有EV來源, 其中包括資訊性術語、來源定義、分離/濃縮技術描述、EVs特性、適當控制的功能研究和綜合報告。
相比之下, MISEV並不是:
- 一個放之四海而皆準的標準, 一份全面的“該做和不該做”的清單或代替詳細的專家判斷; MISEV沒有絕對要求或禁止的技術或平台。同樣的MISEV也不強制使用任何特定的富集標記物, 所選擇的技術和目標應適合其研究目的與實驗系統而有助於總體MISEV的符合性。重要的是, 沒有一個研究團隊能夠接觸到所有的技術和平台。
- 創新的障礙。當引入EVs的新技術或新應用時, 該方法的某些方面可能不完全符合現有的MISEV框架, 或者更有可能不符合審查員對該框架的解釋。參見上文關於絕對授權的內容, 如有必要可援引例外條款; MISEV不應扼殺創新而應告知創新或新技術是如何展示和驗證的。
- 阻止出版或資助某一特定專案的手段。正如MISEV不應該扼殺創新一樣, 其也不應該被用來阻止與學會共用的研究成果; 例如: 不能證明生物發生的“外來體”或“外來體”研究可以改為關於EVs或“EV”報告, 但不能完全定性為更廣泛的細胞外顆粒研究, 這可能需要適當的控制來證明EVs的作用, 但如果無法做到, 則只需承認這些警告即可。
- 全面的引文集。每一篇都充分體現了MISEV的建議, MISEV文獻不是綜述或概要, 此處僅引用了一小部分的EV文獻, 且每一次引用都是出於特定目的。MISEV中的引用並不意味著ISEV認可某個報告、作者團隊、期刊或出版商, 也不表明所引用研究的首要性或完整性, 一些引用的研究也可能包含與MISEV建議不一致的方面; 此外,許多優秀的研究也沒有在本檔中引用。
總之, MISEV的精神體現在幾個問題中:
- 您使用什麼術語, 各別是什麼意思?
- 您從哪裡獲得EVs的?
- 您是如何分離、濃縮、表徵和儲存EVs的?
- 與其他成分相比, 您對EVs的功能或生物標誌物的歸屬有多少信心?
- 您是否充分詳細的共用了資料和報告方法, 以使其他人能夠複製或再現您的結果?
1.3 如何使用MISEV
- MISEV2023旨在幫助任何和所有的EVs研究人員:從剛開始EVs的新手到希望了解EVs行業當前的技術水準和(或)面臨到尖端問題的老牌研究人員。不過其結果是一個大文檔, 這可能會需要一些指導説明。
- 命名(第2章節)適用於所有的EV研究; 清晰且一致的語言將有助於確保結果是可理解和可比較的。
- 對於那些對EVs研究的新手, 我們建議第3–5章節非常重要, 分別涵蓋了樣本採集與處理、EV分離方法和EV表徵的最低考慮事項。
- 第6~第9章節為EV表徵、調節EV釋放和攝取的方法、EV功能研究和體內EV分析提供進一步的技術性指導, 這些章節為讀者提供了決策的最新資訊, 但大部分沒有並給出具體建議。
- 因此MISEV2023中提供的資訊和指南促進了EV科學的嚴謹性、再現性和透明度, 目的是確保所執行的實驗和報告的資訊可支援其結論。
共識: 89.3% (891)的MISEV2023調查受訪者“完全同意”, 10.7% (107)的受訪者“大部分同意”第1部分: ISEV和MISEV簡介; 沒有受訪者不同意(“大部分”或“完全”), 也沒有受訪者表示他們沒有意見和(或)專業知識。
以上內容即非經許可請勿任意複製轉發分享, 如有任何建議或詢問, 歡迎和我們聯繫
2. 術語 - EV定義和EV子分類
2.1 EV定義和EV子分類
定義: ”細胞外囊泡(EVs)”一詞是指從細胞中釋放出來的、由脂雙層界定且不能自行複製 (即不含功能性核) 的顆粒。
保留了MISEV2018中的當前EV定義,但刪除了2018年使用的”自然”(如: 自然釋放)一詞, 以避免意外排除工程化的EVs或在各種細胞培養條件下生產的EVs。
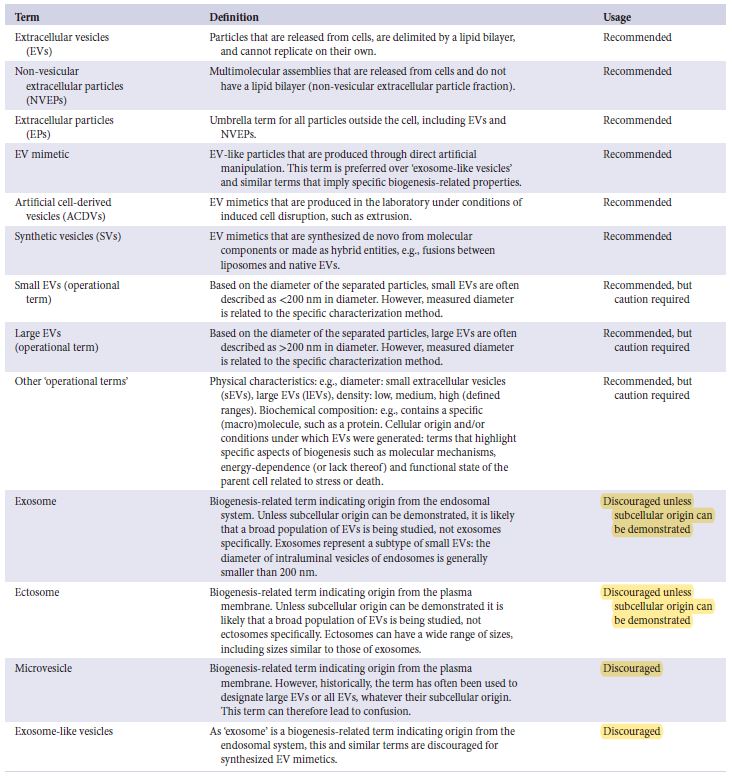
總之, ISEV建議使用通用術語”EV”和該術語的操作擴展說法, 以取代去定義那些不一致且有時會產生誤導的術語, 例如難以確定生物發生途徑相關的"外泌體"(exosomes 和 ectosomes) 字樣。
關於可添加為”EV”首標的”運作術語”(表2), 如果根據大小、密度、分子組成或細胞來源等特徵分離出一種或多種EV的子分類, 則會繼續鼓勵而謹慎的使用。
例如”小”和”大”等術語通常用於表示過去幾年中的EVs群體, 指的是使用過濾或差速超速離心(差速UC, dUC)等方法分離出特定大小的EVs群體; 然而, 儘管”小”通常可能指直徑小於200nm的EVs, 但對於大小的上限或下限卻沒有嚴格的共識, 而且很明顯, 許多分離方法(如dUC)會產生大小分佈重疊的EVs群體。
因此, 雖然這樣的術語可能仍在使用, 但研究人員應該意識到它的局限性, 並努力盡可能清楚地來定義其術語。
如上所述, 與所推測生物發生途徑相關的術語應謹慎使用, 並應附上強而有力的證據; 術語中的exosome(外泌體)是指來自細胞內部隔室並通過多泡體(MVB)所釋放的EVs, 而術語“ectosome”(也稱微泡、微粒)是指來自細胞表面的EVs, 這邊使用了許多專門術語來表示在特定細胞過程中出現的EVs, 例如細胞遷移(migrasomes)或程式化的細胞死亡(apoptotic bodies)。
在某些情況下, 特定EV子分類中的生物發生或釋放可能會受到藥理學或遺傳干預的抑制或刺激(另見7.1); 不幸的是, 大多數的EV分離技術並不能富集到通過不同機制所產生的EVs, 基於生物發生的子分類其表徵確定也很困難, 因為沒有exosome、ectosome或其他EV亞型的單一分子標記。
因此, ISEV不鼓勵使用基於生物發生的術語, 除非對這類EV群體進行了特別的分離和表徵方法。
值得注意的是, ”sEV”(用於小EV)和”exosome”(外泌體)並不是同義詞, 小EV群體包括了exosome和ectosome; 由於上述原因, 大多數現有的”exosome”和“ectosome/microvesicle”文獻都涉及到了廣泛的EVs群體, 而非通過特定生物發生途徑釋放的EVs。
某些類EV粒子可能不完全符合上述EVs的定義, 例如, 如果一個細胞被擠壓後所產生的粒子就沒有嚴格地遵守從細胞中”釋放”的定義。
2.2 EV模擬物 (EV Mimetics)
“EV模擬物"(EV Mimetics, EVM)等術語可用於表示通過細胞直接破碎、通過分子成分從頭合成或通過天然EVs與例如脂質體融合產生的EV類粒子。
無論此類粒子使用何種命名法, 它都將代表的是一般的生產過程, 其粒子與天然EVs的粒子有所區分, 並且不會聲稱其與來自特定生物發生途徑的EVs相似; 也就是說, 避免使用”exosome-like vesicles”和錯誤的暗示特定生物發生的相關特性之類似術語。
2.3 非細胞外囊泡粒子 (NVEPs)
越來越多的人意識到, 多樣性的非細胞外囊泡粒子(Non-vesicular Extracellular Particles, NVEPs)通常會與EVs一起共同被分離出, ISEV學會特別被要求在MISEV2023的階段提供關於如何處理和命名這些粒子的導引。
由於ISEV是EV的專家學會, 因此不能擅自為其他類型的細胞外粒子建立命名法, 例如脂蛋白粒子(LPPs)、核糖核蛋白粒子(RNPs)、病毒或各種新提出的粒子類型, 如: exomeres和supermeres(外泌超小體)。
然而, EVs如何與其他粒子相關聯, 以及如何將它們與其他粒子分離並在複雜的混合物中與其他粒子一起表徵, 這些都與EVs領域密切相關。
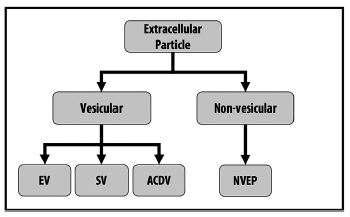
因此, MISEV2023提供了以下的術語建議, 同時認識到可能需要其他的術語來提高清晰度(Figure 1, table 2)。
Table 2. EV命名和相關述語的快速參閱卡
Figure 1. EP命名的階級。細胞外粒子包含了囊泡和非囊泡粒子。此表說明了在EPs類別之間的幾種區別和可能的命名方式: 細胞外粒子(Extracellular Particle, EP); 細胞外囊泡(Extracellular Vesicle, EV); 合成囊泡(Synthetic Vesicle, SV); 人工細胞衍生物囊泡(Artificial Cell-Derived Vesicle, NVEP); 非囊泡細胞外粒子(Non-Vesicular Extracellular Particle, NVEP)。也可見Section 2和Table 2。
細胞外粒子(Extracellular Particles, EPs)是細胞所衍生由奈米至微米大小的多分子組裝體首選術語, 包括EVs和非囊泡狀實體。
非細胞外囊泡粒子(Non-vesicular Extracellular Particles, NVEPs)是由一種或多種分子類別(如蛋白質、核酸)之細胞衍生組分所形成的所有非EV粒子; 例如脂質(如果存在的話)就不會形成一個有所界定的雙層膜; NVEPs和EVs可能會具有重疊的物理化學性質, 並且在生物基質中的NVEPs數量可能會大大超過EVs。
因此, 大多數Eps的分離方法都會導致NVEPs和EVs共分離存在, 同樣的, 許多EPs的表徵方法並不能特異性識別EVs; 小於EVs的NVEPs可能會無法經由某些EV表徵方法而檢測到, 因此其在EPs製劑中的數量可能還仍然未知。
因此, 當EVs和NVEPs不能完全區分時, 術語”EPs”可能是適用的, 或者使用"EV製劑"或"含EV的製劑"。
建議:
1. “細胞外囊泡”是指由脂質雙分子層包裹且不能自行複製的粒子。
2. 鼓勵使用表定的運作術語, 但也要注意因為這些術語可能會受到其分離方法的影響。
3. 除非能夠證明特定條件和EV的亞細胞來源, 否則不建議使用生物發生的術語。除了少數的例外情況之外, 代表所研究的是廣泛之EVs群體, 而非特定的ectosomes或exosomes。
4. “細胞外粒子”是細胞衍生奈米至微米尺寸範圍的多分子組裝體總稱, 包括囊泡狀和非囊泡狀實體。
5. “非細胞外囊泡粒子”是一個準確的術語, 指本質上是非囊泡狀的細胞衍生多分子組裝體(即細胞外顆粒的非囊泡狀部分)。
共識: 79.5%(793)的MISEV2023調查受訪者”完全同意”, 19.9% (199)同意第2節:術語中的”大部分”。0.4% (4)”大多數”不同意, 0.2%(2)表示沒有意見和(或)專業知識; 沒有受訪者“完全”不同意。
以上內容即非經許可請勿任意複製轉發分享, 如有任何建議或詢問, 歡迎和我們聯繫