病毒與類病毒於奈米醫學領域的應用
VIRUSES AND VLPS IN NANOMEDICINE
分離與定量的重要性
病毒通常是一種直徑小於300奈米的奈米顆粒, 是由蛋白質亞基組分的衣殼內由某種蛋白質包覆的核酸(DNA或RNA)的相似整體結構組成。依照病毒的生命週期, “衣殼”可能會被宿主細胞衍生的脂質層所包覆, 而感染性的病毒則會非常依附於宿主細胞以能取得能量和進行大分子合成的機器, 最終能自我複製。
在疫苗的相關發展中, 病毒的運用在公共健康領域已是關鍵且為其中一個巨大的成功。因其具備多能性和生物工程表徵, 病毒已具備可用來使許多病毒類疾病和非病毒類傳染病的預防/控制的可能性。
病毒必須經過提取的過程, 才能在感染和發病相關研究時進行病毒載體測量, 包含治療潛力的效用, 而”純化”病毒在生物製程的優化時也是需要的, 包含在疫苗或治療用的病毒/類病毒製劑的生產。
病毒分為兩種:
第一種: 只有蛋白質衣殼的無包膜病毒
第二種: 有脂質層覆蓋衣殼的包膜病毒
無包膜的病毒離開宿主細胞的主要機制是通過裂解宿主細胞膜, 因此, 無包膜的病毒可以藉由培養和人工裂解攜帶病毒的細胞(貼壁或懸浮細胞)在體外進行提取, 接著就從細胞裂解物的上清液中做純化, 優化細胞裂解的方式可保持病毒的完整度, 通常運用裂解液、超聲波和凍融循環過程。
相反的, 包膜病毒可從宿主細胞膜出芽時獲得包膜, 因此, 提取從自然狀態下釋放到細胞外空間的病毒就是最常見的方式, 通常不經由細胞裂解, 而是收集從感染的細胞的上清液。
關鍵的分離方式
Isolation

當顆粒懸浮在複合的細胞衍生流體中, 從非病毒結構/分子中純化病毒會經由某些提取技術, 例如超高速離心(UC)、密度梯度離心(DGC, 或蔗糖超速離心)、共沉澱法和尺寸排阻色譜(SEC)等方式。
然而, UC或DGC這種傳統方式面臨著需要昂貴的一次性設備投入與產能可擴展性的限制; 相反的, SEC方式可提供快速使用、成本可控、省力和可標準化的方式, 因此以已有越來越多的奈米顆粒的研究者採用, 包含病毒領域。

在提取病毒方案關鍵的考量是, 其會與相關的生物顆粒有持續相似之處, 例如細胞外囊泡/胞外體(Extracellular Vesicles, EVs)。EVs和病毒共享了一些生物特徵(例如粒徑、密度), 由包膜病毒和富含細胞來源的細胞衍生膜一起釋放到細胞外的空間, 當要將病毒和EVs分離時, 這通常會導致決定提取方案時的挑戰。
最終, 考慮病毒提取的方案是建立在特定實驗的需求上, 但也很大成分的取決於目標病毒的粒徑和密度以及這些參數與EVs的重疊性; 無包膜病毒(通常為 20-100 nm)通常比包膜病毒(通常為 100-1000 nm)粒徑更小, 舉例來說, 因在血漿或在體外培養的細胞上清液時, EVs的數量濃度遠比病毒高, 因此如何選擇對的方式就是關鍵, 直接導致了病毒顆粒從非病毒顆粒中分離的成功或失敗。

qEV Columns (SEC)
由 IZON Science 開發的 qEV Columns (SEC) 在將病毒從細胞上清液或其他生物流體中提取時, 具備快速、非破壞性和可重複性, 同時也做到了與散裝總蛋白的清晰分離。qEV/35nm與qEV/70nm這兩種孔徑的columns, 代表著其可充分優化35-350 nm 和 70-1000 nm的粒子提取, 這就包含了絕大多數的病毒粒徑。
原理即是, 小於35 nm或70 nm的粒子會流經過 qEV columns 之”固向樹酯的孔洞”內而較慢流出, 相反的, 無法進入孔洞的較大粒子就會較快流出。因此, 較小的類似腸道病毒等(約25 nm), 這樣的粒子就會從在qEV columns主要餾份(fractions)中快速洗脫的EVs中分離出來, 即其會出現在較後面的餾份中。建議是使用前將樣品做一道過濾的步驟, 以提高SEC原理的有效性, 可依照目標病毒的粒徑選擇0.22或0.45 µm的過濾器。
以 Ebola virus(伊波拉病毒)舉例, 其包含了ssRNA的病毒。平均的看, Ebola 病毒有1-2 µm 長度, 因此使用0.22 µm的過濾器就可從細胞上清液中所衍生的小EVs中提取出大部分的 Ebola病毒
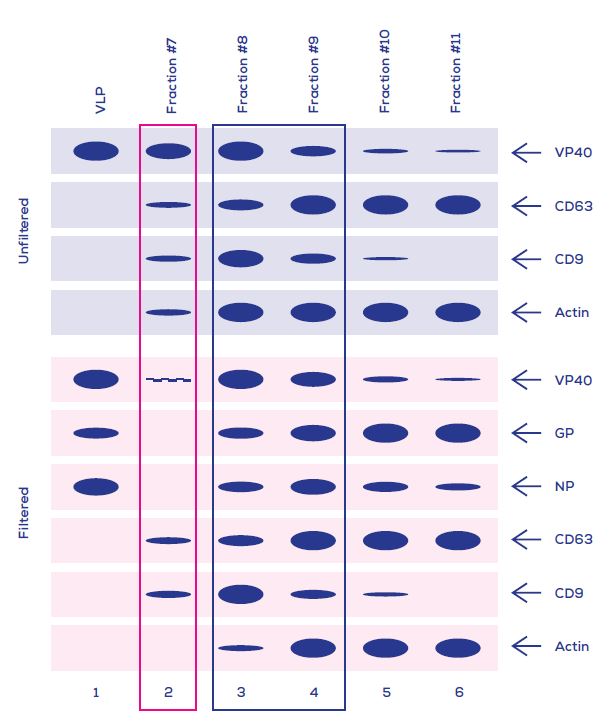
Figure 1. 使用qEV columns (IZON)以尺寸從EVs中分離包膜的伊波拉病毒/類病毒. VLP 標記物陽性對照圖譜(VP40, 核蛋白(NP)和GP)顯示在第1線中, 而從VLP-表達細胞的上清液中之未過濾(上層)或已過濾(底層)的qEV收集體積典型圖譜顯示在第2-6線中.
EVs的標記物是CD63, CD9和Actin. qEV收集體積中已知洗脫的類病毒指示於粉色盒塊中, 而只有包含EVs沒有病毒粒子的餾份指示於藍色盒塊中.
再以 Lentivirus (慢病毒) 舉例, 其為包膜病毒(80-100 nm), 粒徑非常接近小EVs。藉由蛋白定量、顆粒計算、反轉錄酶活性測定和慢病毒衣殼免疫印跡等方式, 顯示其中有一個餾份可包含主要和最大豐度的慢病毒顆粒。
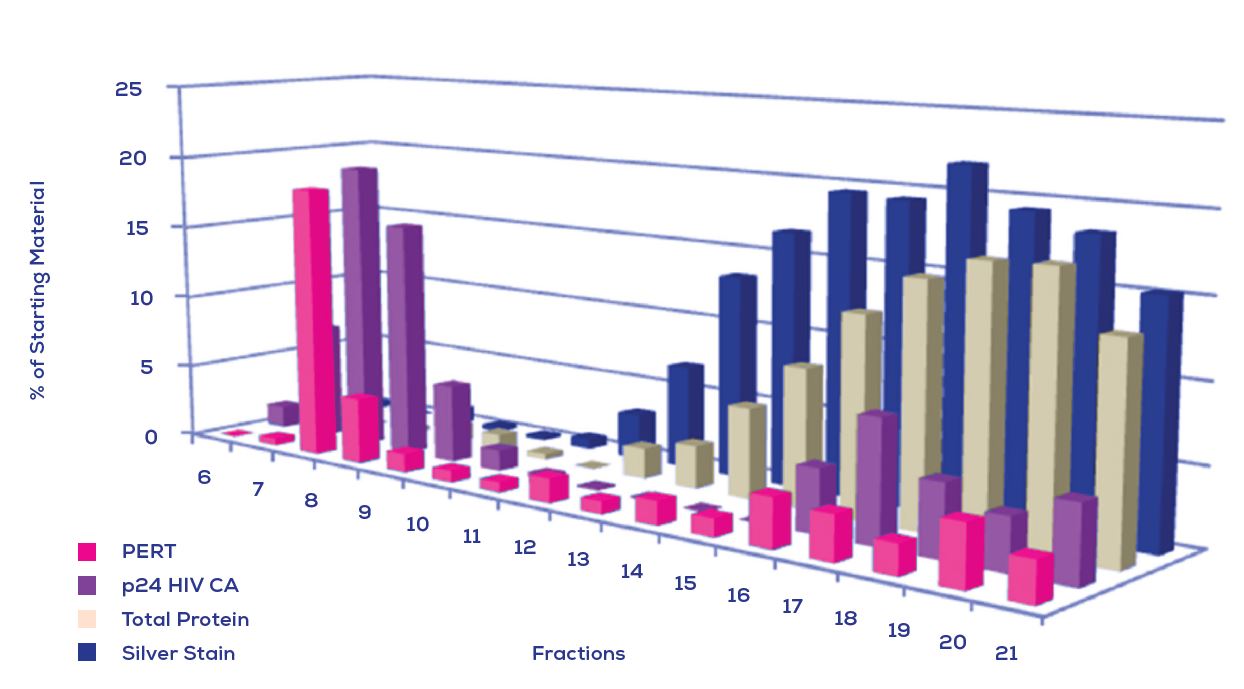
Figure 2. 從qEV columns(IZON)純化包膜慢病毒病毒體的生化表徵. 由PERT(產品增強的逆轉錄酶)分析(粉色柱條)qEV的每個餾份液體, p24 HIV CA 蛋白(紫色柱條)的免疫印跡, 總蛋白(米色柱條)和銀染(藍色柱條). 這顯示出病毒特異性標記 (PERT和p24)是最突出的在早期餾份(7-10)中, 但會在餾份8附近做聚集.
與此同時, 需要注意的是以抗體或免疫印跡為原理分離所進行之純度測定, 比如上述的伊波拉病毒, 其衣殼蛋白 VP40 可與EVs相關, 特別是外泌體(Exosome, sEVs), 其已知VP40蛋白會在外泌體的生物路徑"ESCRT"通路中相互作用, 因此如要從是否有衣殼蛋白的標準來做伊波拉病毒分離時, 就很有可能會造成高產率但低純度的現象(混雜了病毒與EVs)。
關於類病毒
Virus-like Particles (VLPs)
類病毒(VLPs)泛指沒有包含遺傳物質的病毒粒子。現已存在的VLPs有多種衣殼結構變異, 例如1-4種結構蛋白、1-2層衣殼蛋白、是否有包膜、是否有修飾的衣殼和是否有異源核酸/蛋白質的包裝。眾多的細胞表達系統可被用以製備VLP, 包含細菌、酵母、昆蟲細胞或哺乳動物細胞。VLPs的組裝也可發生在細胞或體外, 比如以透析為主的野生型重組純化衣殼單元或大腸桿菌中產生的無包膜鼠多瘤病毒(MuPyV), 因此, 依照所要達到的製造目標, 從細胞上清液中得到的VLPs純度非常高, 能直接繼續做下游的分析。
以SEC原理來提取VLPs可達到75%-95%的粒子計數或94%的衣殼蛋白免疫印跡, IZON qEV columns (SEC)不需要用到嚴格或需要組合的緩衝液, 不會改變VLPs的本質和其衣殼/抗體的結構。
推薦在使用qEV columns前加上前處理的清洗步驟, 可分離包含團聚細胞、細胞碎屑和其他奈米粒子的干擾。
病毒與類病毒的定量
傳統上快速測定在緩衝液中的病毒和類病毒可經由測量~214, ~260, ~280 nm波段的紫外光吸收波長, 分別為肽、DNA和蛋白的定量。然而作為一種間接又粗略的方式, 例如光學手段, 就會有其限制: 比如說無法計算到單粒子, 當病毒/類病毒製備是由包含可變核酸與蛋白比例之異質生物流體中時, 這種方式顯然無法提供準確的結果。
基於病毒/類病毒製備特徵和預期的目標, 是有其他更準確而合適的定量方式, 例如用於減活病毒疫苗的病毒製備就預期能在受者體內複製並引起和自然感染相似的免疫反應。失去對自然宿主毒力的減活疫苗通常是由細胞培養連續傳代而產生, 然而在生產過程中,該製劑中的一些病毒粒子可能是有缺陷或不具傳染性的, 即是單一衣殼含有部分核酸內容或完全沒有核酸的空衣殼。
在這種情況時, 為了能填補粒子的絕對量化手段, 對於病毒粒子感染性的關聯程度所進行的活性測定就變成具有強制性, 比如於流感病毒中, 病毒濃度就與血凝活性測定相關, 或是針對慢病毒, HIV等逆轉錄病毒的逆轉錄酶活性測定。
為了製造減活疫苗的病毒製備, 通常會經由物理或化學的減活來降低其感染性或複製的能力來引發更高需求的抗體或病毒粒子來達成想要的免疫反應; 因為這種疫苗方式的限制, 準確的病毒定量就變得更為關鍵用以達成劑量濃度標準。
疫苗的類病毒製備, 就定量而言被視為減活病毒, 因其需要類似高劑量的病毒粒子來進行免疫反應, 然而其表面抗原並不會在病毒疫苗的減活過程中可能發生的被改變或損毀。
因此在疫苗開發和生產中, 目標粒子的準確定量非常關鍵, 產量的可靠性測量對於品管至關重要, 必須知道產品的正確濃度來確保適合的劑量。
至今已有許多替代方法以用來定量病毒粒子濃度, 可能包含經典的斑塊形成測定、以抗體為概念的技術例如ELISA, 生物活性基底的測定、PCR、標示粒子的流式細胞術等等, 然而這些技術通常僅為實驗性質且耗時, 且常不夠靈敏或兼容更多的下游分析。
以電子顯微鏡為基礎的影像技術, 例如穿透式電子顯微鏡(TEM), 冷凍電鏡(CyroTEM)和掃描式電子顯微鏡已是病毒歷史的基礎, 可進行病毒/類病毒準確的大小測量和超微結構的分析小至20 nm, 例如B型肝炎病毒/類病毒。然而以粒子物理表徵的電子顯微鏡基礎的技術解析度, 由於明顯缺乏高通量樣品的處理能力而受到阻礙, 其樣本的製備與分析需求不只是方案冗長、非常昂貴且需要有特定的儀器與操作員的技術。
在此之前, 病毒/類病毒的定量並沒有一個單一且通用的可接受方式, 而現在正迫切需求可簡化於臨床設置中單純、快速而又可信賴的方式。單粒子分析方式以Particle-by-Particle測量, 即可評估異質性奈米粒子的關鍵參數分佈, 可如預期的在所有細胞培養系統中的生產。
然而, 病毒/類病毒的定量不只是因其和EVs與一些病毒有像似大小的挑戰, 也因其病毒宿主細胞衍生EV中的病毒蛋白質和核酸存在, 會因其標記物而導致了不準確的病毒定量。
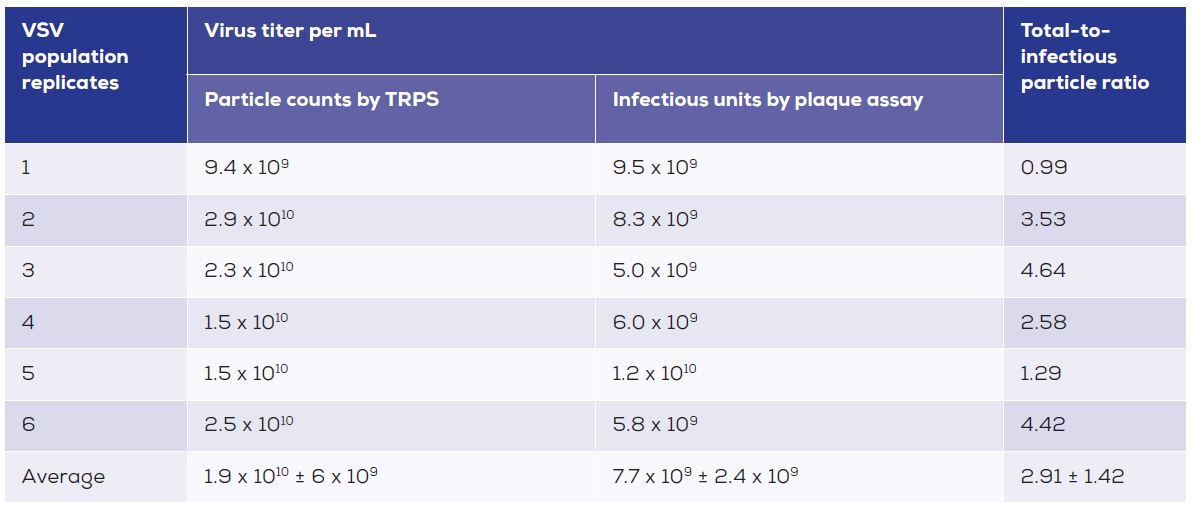
符合上述的需求, TRPS (Tunable Resistive Pulse Sensing, 可調式電阻脈衝感應)技術, 使用了病毒/類病毒在通過奈米孔洞(Nanopore)時的”瞬時”電阻增加或脈衝來進行粒子的定量; 其特點是可分別以測量脈衝訊號的數量、強度與持續時間, 得到病毒/類病毒粒子的濃度、粒徑與界達電位(zeta potential), 是一個可進行高輸出測量的單顆粒方式, 不需螢光標記或高技術含量的方案, 突破該領域朝”直接”而非間接測量技術的限制, 而搭配qEV column (SEC)的純化過程又可加速製備時的效率, 可直接以TRPS技術進行精準的定量分析。
表1. 分別由TRPS(qNano, IZON)測量和噬菌斑測定於VSV(水泡性口炎病毒)製備時所有/已感染之粒子比例的總表. 這顯示出從生物重複和低比例已感染粒子之間的一致性.
事實上, 對於定量小粒徑的病毒/類病毒的方式是個挑戰, 但TRPS方式即可提供真實顆粒粒徑分佈和樣品異質性的準確圖示, 而不像以光學為原理的技術只能提供平均粒徑, TRPS可提供的是單一顆粒測量並精準解析複合模型或多分散性的樣品, 例如從細胞培養液中的衍生物。更多的是, TRPS技術比被視為”gold standard”的電子顯微鏡為原理的定量方式表示了更寬的顆粒濃度範圍。舉例來說, TRPS技術被用來應用於Eblot病毒/類病毒的疫苗應用, 其疫苗製備時已藉由破壞大絲狀的類病毒和凍乾(提高熱穩定性)以進行優化, 可同時保存受測動物體的保護性免疫反應。
Figure 3. TRPS在病毒/類病毒的製備中: (A). 以qNano(IZON)評估從STAR-A-HV病毒製備時qEV(IZON)粒子富含餾份(7, 8 與 9)的病毒粒徑分佈. 這表示每個粒子富含餾份中的粒徑分佈沒有明顯變化
(B). 以qNano(IZON)評估在經過超聲波和通過0.45 μm(藍) 或 0.8/0.2 μm(粉)過濾器時伊波拉病毒/類病毒製備的粒徑分佈評估. 這表示兩種過濾會保留更小的粒子而更容易操控疫苗配方.
類病毒已徹底改變了疫苗學領域, 不只是其展示了抗原表達的龐大重組可能性, 也是其有經由智能合成生物學設計來改良效率的可能性; 無包膜類病毒衣殼中的抗原通常會經由基因工程或化學共軛來修飾, 而包膜類病毒的脂質層會由一個稱為假型化的過程來修飾, 其包含了修飾宿主細胞系統膜中存在的抗原決定位。
同時間型態的表徵(藉由高解析度影像)在功能證實和蛋白單元重組中是關鍵的, 而一個可靠且高解析度的定量方式在類病毒製劑的綜合分析和劑量優化研究中仍然是需要的。
與此同時, TRPS技術已被用來在製劑穩定研究中得到準確的測量數值, 例如伊波拉病毒/類病毒用於疫苗中, 在此研究中, 製造過程會藉由類病毒大絲狀的破壞(超音波)來改良且藉由類病毒的冷凍乾燥來增加熱穩定性, 同時在受測動物中保留有保護性的免疫反應。因此, TRPS技術可確保連續性的測量和在不同的時間點得到可靠而一致性測量的能力, 允許在不論短或長時間下樣本穩定度和團聚性都可被評估, 這是疫苗發展的必要分析。
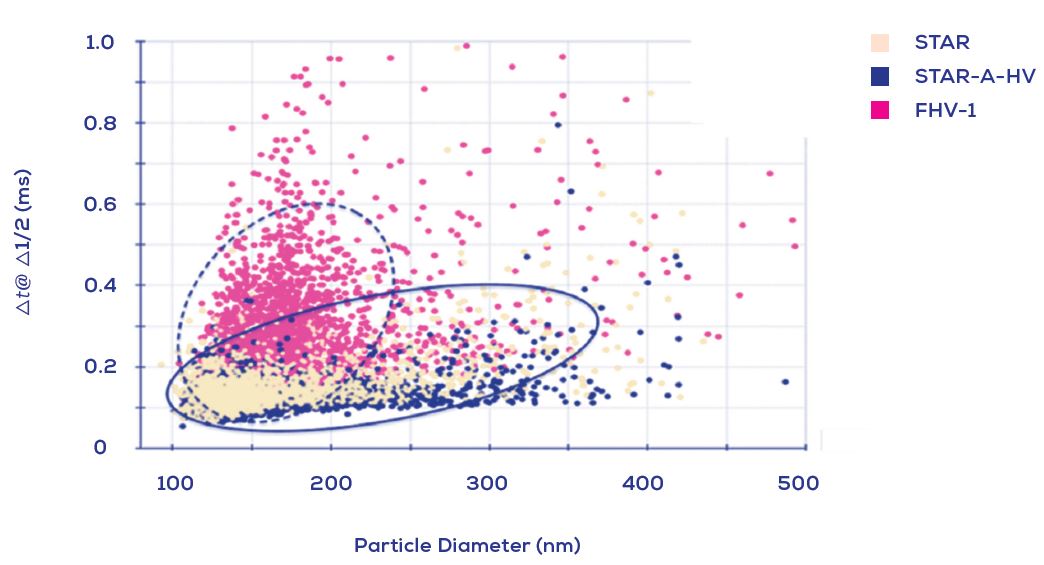
Figure 4. 由TRPS(qNano, IZON)分析不同病毒製備的界達電位. 點狀顯示在三個病毒製備的病毒粒子直徑與界達電位關係: STAR, STAR-A-HV衍生的粒子和FHV-1粒子. 這顯示出從STAR和STAR-A-HV細胞在兩種慢病毒製備沒有界達電位的差異, 然而在皰疹病毒 FHV-1顯示出有個不同的模式, 會轉移到更具負電位(破碎橢球體).
許多的生物性相關作用都牽涉到其界達電位(或稱zeta potential), TRPS技術可 Particle-by-Particle 測量界達電位的能力, 提供了為病毒粒子/類病毒製劑進行了更全面表徵分析的獨特機會。
界達電位(zeta potential)是奈米粒子在特定介質的有效電位測量, 其代表粒子與粒子和粒子與介質吸引的膠體穩定度。 在這之中, 奈米粒子的 zeta potential 可用以判斷病毒/類病毒製備時的粒子會傾向團聚或維持分散狀態。同時, 奈米粒子的界達電位也顯示出其是否會影響細胞的攝取效率和受體宿主細胞的毒性作用程度, 可說是相當重要。
為了強調電荷在病毒攝取中的重要性,研究表明,菸草花葉病毒(TMV) 外殼蛋白(CP) 中重組表位的單一氨基酸替換能夠改變其預測的等電點(代表蛋白質電荷)並從根本上改變天然植物宿主細胞的感染性。
相關產品
 外泌體尺寸排阻色譜管柱 qEV columns (SEC) |
 外泌體自動餾份收集機 AFC-V2 |
 單顆粒奈米粒徑/數量濃度/Zeta膜電位分析儀 Exoid Nanoparticle Analyzer (TRPS) |
以上內容非經許可請勿任意複製轉發分享
更多的相關訊息, 歡迎和我們聯絡或來信洽詢: info@normanda.com